암세포의 autophagy, reprogram된 macrophage, glioblastoma의 재구성된 혈관계는 tumor immunity를 유발합니다. (Journal: Cancer Cell)
Abstract
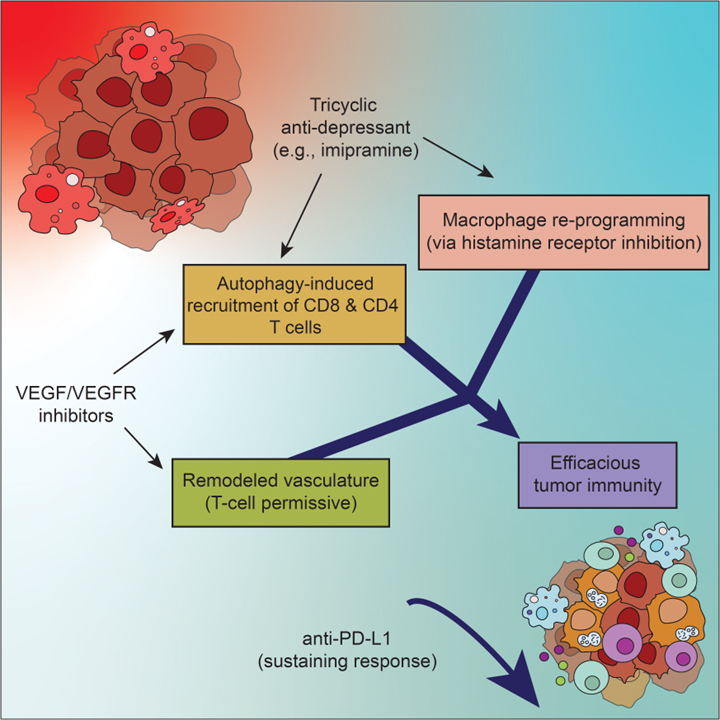
Glioblastoma (GBM)는 치료가 어렵고 인간에게 치명적입니다. 난치성을 피하기 위한 전략으로 tumor progression과 therapeutic resistance에 필요한 여러 기능을 동시에 억제하는 것을 목표로 해당 질병의 distinctive mechanistic component를 co-target 하는 것입니다. 우리는 tumor의 혈관 구조를 변화시키는 vascular endothelial growth factor (VEGF) 경로 억제제를 tricyclic antidepressant인 imipramine (IM)과 결합하여 이 전략을 진행했습니다. 두 약물 모두 단독 요법으로는 효과적이지 않지만 imipramine과 VEGF 경로 억제제를 조합하여 처리하면 CD8 T, CD4 T cell의 infiltration과 activation을 조절하여 여러 가지 GBM mouse model에서 상당한 치료 효과를 보입니다. 궁극적으로는 재발하는 tumor에서 anti-programmed death-ligand 1 (PD-L1)을 사용한 immune checkpoint 차단을 먼저 진행하면 생존 가능성을 더 높여줍니다. 이러한 결과는 tumor microenvironment에서 서로 다른 생물학적 취약점에 대한 mechanism-guided therapeutic co-targeting의 가능성을 보여줍니다.
Figures
Fig 1. IM + anti-VEGF 조합은 GBM 마우스의 생존을 연장하고 immunostimulatory 특징을 가집니다.
(A) Glioma의 lentiviral-induced mouse model에서 장기간 치료법의 개략도.
(B) 말기 LVRshp53 동물의 종양을 H&E tissue staining 한 이미지.
(C) 각 치료를 받은 종양 보유 LVRshp53 동물의 생존 그래프.
(D) 2주 동안 각 방법대로 치료한 LVRshp53 동물의 정규화된 생물발광 정도.
(E) 각 치료를 받은 PDG 동물의 생존 그래프.
(F) CD8과 DAPI nuclear staining의 이미지.
(G) IM + anti-VEGF-treated 종양과 Ctrl에서 CD8 T 세포의 고배율 이미지.
(H) 12일 동안 각 방법대로 치료한 LVRshp53 종양에서 CD8 T 세포의 정량화.
(I) 12일 동안 각 방법대로 치료한 LVRshp53 종양에서 CD8 T 세포의 유세포 분석 결과. 세포는 CD45+CD3+CD8+로 gating 진행.
(J) 12일 동안 각 방법대로 치료한 LVRshp53 tumor tissue section CD4 T 세포의 대표적인 이미지.
(K) 12일 동안 각 방법대로 치료한 LVRshp53 tumor tissue section CD4 T 세포의 정량화. (L) 생존 가능성에 대한 CD8 T, CD4 T 세포의 기능적 기여 평가.
(M) 각 방법대로 치료한 LVRshp53 마우스에서 정규화된 생물발광 정도.
Fig 2. IM + anti-VEGF 처리 시 CD8 T, CD4 T 세포가 활성화됩니다.
(A) Effector T cell (CD62L-CD44+)의 유세포 분석 결과.
(B) 고정 및 투과성 CD8+T 세포에서 IFNγ 세포 내 염색의 FACS 분석 결과.
(C) CD8 T 세포에서 GzB 세포 내 염색의 유세포 분석 결과.
(D) CD8 T 세포에서 TNFα 세포 내 염색의 유세포 분석 결과.
(E) 표시된 치료를 받은 LVRshp53 동물의 생존을 위한 IFNγ의 기능적 중요성.
(F) CD8 T 세포에서 Ki67의 유세포 분석 결과.
(G) CD8 T 세포에서 pSTAT5의 유세포 분석 결과.
(H) CD8 T 세포에서 TCF1의 유세포 분석 결과.
(I) anti-VEGF로 처리된 종양에서 HIF-1α와 CD8의 대표적인 이미지.
(J) GBM 종양 full section의 전체 영역에서 저산소 영역에 대한 CD8 T 세포의 접근 정도 정량화.
(K) 고정 및 투과성 CD8 T 세포에서 세포 내 HIF-1α 발현의 유세포 분석 결과.
(L) CD4 T 세포에서 세포 내 FOXP3 발현의 유세포 분석 결과.
(M) CD4 T 세포에서 세포 내 TGFβ 발현의 유세포 분석 결과.
(N) CD4 T 세포에서 SLAMF7 발현의 유세포 분석 결과.
(O) CD4 T 세포에서 GzB 발현의 유세포 분석 결과.
Fig 3. anti-VEGF 단독 또는 IM과의 조합은 glioblastoma의 종양 혈관계를 리모델링합니다.
(A) 1주 동안 각 방법대로 치료한 LVRshp53 종양의 systemically perfused lectin, CD31, DAPI의 이미지.
(B) 1주 동안 각 방법대로 치료한 LVRshp53 종양에서 CD31+ 면적의 백분율.
(C) CD31+ 면적의 백분율 중 i.v.-infused lectin과 CD31 co-localization의 비율.
(D) CD31 양성 영역의 백분율로 PDGFRβ 및 CD31 co-localization의 정량화.
(E) CD31 양성 영역의 백분율로 PDGFRβ 및 CD31 co-localization의 이미지.
(F) GBM 종양 section의 전체 영역 중 가장 가까운 CD31+ 혈관 (10-25μm) 이상 10μm 이내에 위치한 CD8+ T 세포의 fraction의 이미지.
(G) GBM 종양 section의 전체 영역 중 가장 가까운 CD31+ 혈관 (10-25μm) 이상 10μm 이내에 위치한 CD8+ T 세포의 fraction의 정량화.
(H) 전체 종양 tissue section의 전체 영역 중 MECA79, CD31, DAPI 및 HEV IF 이미지.
(I) 전체 종양 tissue section의 전체 영역 중 MECA79, CD31, DAPI 및 HEV 정량화.
(J) Endothelial cell marker의 mRNA 발현 양.
Fig 4. Imipramine은 TAM에서 M2-like program을 하향 조절합니다.
(A) IM 또는 anti-VEGF로 처리되거나 처리되지 않은 단일 종양에서 ARG1, IL-10의 웨스턴 블롯 분석 결과.
(B) 각 조건으로 1주 동안 처리된 GBM 종양에서 ARG1, IL-10 발현의 유세포 분석 결과. Macrophage는 CD45+CD11b+Ly6C-Ly6G로 gating 진행.
(C) Untreated tumor에서 FACS에 의해 평가된 microglia (CD49d-)와 MDMs (CD49d+)에서 ARG1와 IL-10의 발현 양.
(D) 유세포 분석에 의해 평가된 microglia 내 MHC-II 발현 양.
(E) 종양 CD11b 세포와 활성화된 splenic CFSE-labeled CD8 또는 CD4 T 세포의 ex vivo co-culture 결과.
(F) Ctrl과 IM-treated M2-like BMDM의 qRT-PCR를 통한 M2-like program in cytokine-polarized macrophage 분석 결과.
(G) FACS에 의해 평가된 BMDM의 M1-like program 분석 결과.
(H) Ctrl 또는 24시간 동안 IM으로 처리된 ex vivo M1-, M2- polarized BMDM에서 18S로 정규화된 Hrh1 mRNA의 발현 양.
(I) FACS-sorted microglia 또는 Ctrl과 IM-treated 종양의 MDM에서 Hrh1의 mRNA 발현 양.
(J) siCtrl 또는 2개의 서로 다른 siHrh1로 transfection 된 M2-polarized macrophage Arg1, Chil3, Il10의 mRNA 발현 양.
(K) siRNA-transfected M2 BMDM의 MRC1, ARG1 발현의 웨스턴 블롯 분석 결과.
(L) Untreated 또는 TFP 처리 종양에서 분리된 종양 CD11b 세포와의 co-culture 동안 CD8 T, CD4 T 세포의 증식.
(M) IM, TFP, Ctrl로 처리된 종양에서 분리된 CD11b 세포 내 Hrh1, Arg1, MMP2의 mRNA 발현 양.
(N) 녹색 pHrodo S. aureus bioparticle로 분석된 untreated 또는 IM-treated 종양의 분류된 microglia와 MDM을 포함하는 phagocytosis 분석 결과.
Fig 5. HRH1의 낮은 발현 정도는 생존과 관련이 있으며 antihistamine 치료는 GBM 환자에서 더 좋은 예후를 보입니다.
(A) AffyU133a expression array로 분석된 TCGA GBM 코호트에서 Kaplan-Meier 전체 생존 분석 결과.
(B) AffyU133a expression array로 분석된 TCGA GBM 코호트에서 Kaplan-Meier 무진행 생존 분석 결과.
(C) Antihistamine 치료를 받았는지 여부에 따른 GBM 환자의 전체 생존에 대한 Kaplan-Meier 추정치.
Fig 6. Macrophage-derived CXCR3 ligand는 IM + anti-VEGF의 조합 요법에 의한 치료 효과에에 필요합니다.
(A) 벌크 종양에서의 Cxcl10 및 Cxcl9 발현 양.
(B) IM + anti-VEGF로 처리된 LVRshp53 종양의 CXCL10, F4/80, DAPI의 이미지.
(C) Untreated, anti-VEGF, IM 또는 IM + anti-VEGF로 처리된 종양의 TAM에서 CXCL9 발현에 대한 유세포 분석 결과.
(D) (C)와 같이 평가된 MDM, microglia에서의 CXCL9 발현 양.
(E) IM + anti-VEGF ± aCD49d로 처리된 벌크 종양에서 평가된 Cxcl9, Cxcl10 mRNA 발현 양.
(F) 각 처리를 받은 LVRshp53 동물의 생존에 대한 CXCR3 기능의 기여도 평가.
(G) CXCR3의 효과를 평가하기 위한 CD8 T 세포의 이미지.
(H) 각 치료를 받은 종양에서 CD8 T 세포의 유세포 분석 결과.
(I) 종양 유래 CD11b 세포와 CFSE-labeled CD8 T 또는 CD4 T 세포의 ex vivo co-culture.
(J) αCXCR3, IM + anti-VEGF 또는 삼중 조합으로 처리된 종양에서 CD8 T 세포의 IFNγ 분비에 대한 최소 효과.
(K) IM + anti-VEGF 공동 처리된 CD8 T 세포에서 GzB 분비에 대한 αCXCR3의 효과 없음.
(L) IM + anti-VEGF 공동 처리된 CD8 T 세포에서 TNFα 분비에 대한 αCXCR3의 효과 없음.
(M) IM + anti-VEGF 또는 IM+ anti-VEGF + αCXCR3으로 처리된 종양에서 HEV에 대한 IF의 정량화.
Fig 7. PD-L1은 재발성 종양에서 유도되고 이의 차단은 T cell의 기능을 강화하여 GBM 마우스의 생존을 연장합니다.
(A) 각 방법으로 처리된 종양의 생존 세포 구획에서 PD-L1에 대한 FACS 분석 결과.
(B) IM + anti-VEGF 후 재발성 종양에서 PD-L1, CD45, DAPI에 대한 IF 이미지.
(C) 유세포 분석에 의해 밝혀진 바와 같이 재발성 GBM 종양의 CD45-, CD45+ 구획을 비교하는 PD-L1 양성 생존 세포의 백분율.
(D) 유세포 분석에 의해 평가된 종양에서 CD45+ 세포의 CD11b-, CD11b+ 구획에서의 PD-L1 발현 양.
(E) FACS에 의해 평가된 PD-L1-positive TAM의 백분율.
(F) TAM에서 PD-L1 발현을 나타내기 위한 IF.
(G) 유세포 분석에 의해 평가된 재발성 종양의 MDM, microglia에서 PD-L1의 발현.
(H) 유세포 분석에 의해 평가된 반응성 및 비반응성 종양을 비교하는 microglia에서의 MHC-II 발현 양.
(I) IM + anti-VEGF 처리하여 미처리, 반응성, 재발성 종양에서 CD8 T 세포의 이미지.
(J) IM + anti-VEGF 처리하여 미처리, 반응성, 재발성 종양에서 CD8 T 세포의 정량화.
(K) IM + anti-VEGF 또는 IM + anti-VEGF + αPD-L1으로 단기간 처리된 종양에서 CD8 T 세포의 abundance에 대한 유세포 분석 결과.
(L) (K)와 같이 처리된 종양의 CD8 T 세포에서 GzB 발현 양.
(M) (K)와 같이 처리된 종양의 CD8 T 세포에서 IFNγ 발현 양.
(N) (K)와 같이 처리된 종양의 CD8 T 세포에서 TNFα 발현 양.
(O) anti-PD-L1의 early incorporation과 late incorporation의 이점 평가.
(P) 전체 연구 결과에 대한 개략도.