Binary pharmacology를 사용한 뇌 제한 mTOR 억제
Abstract
On-target-off-tissue 약물 작용은 약물 후보군에서 치료를 제한하는 역효과의 중요한 원인입니다. 중추 신경계 질환에서 뇌 제한 약리성을 가진 약물이 그 예시입니다. 여기에서 우리는 뇌 투과성 mTOR 억제제 RapaLink-1와 뇌 불투과성 FKBP12 ligand RapaBlock의 사용을 통해 다른 곳에서는 mTOR 활성을 보존하면서 rapamycin (mTOR)의 포유동물 내 표적 억제를 달성하는 방법을 보였습니다. 우리는 이 약물 조합이 mTOR 억제제가 전신에 작용하는 것은 완화하지만 glioblastoma xenograft에서 RapaLink-1의 효능을 유지한다는 것을 보여줍니다. 우리는 알려져 있는 drug scaffold에서 세포 투과성 FKBP12-dependent kinase inhibitors를 설계하는 일반적인 방법을 추가로 제시합니다. 이러한 억제제는 RapaBlock에 의한 비활성화에 민감하여 각각의 kinase 표적에 대한 뇌 제한 억제를 가능하게 합니다.
Figures
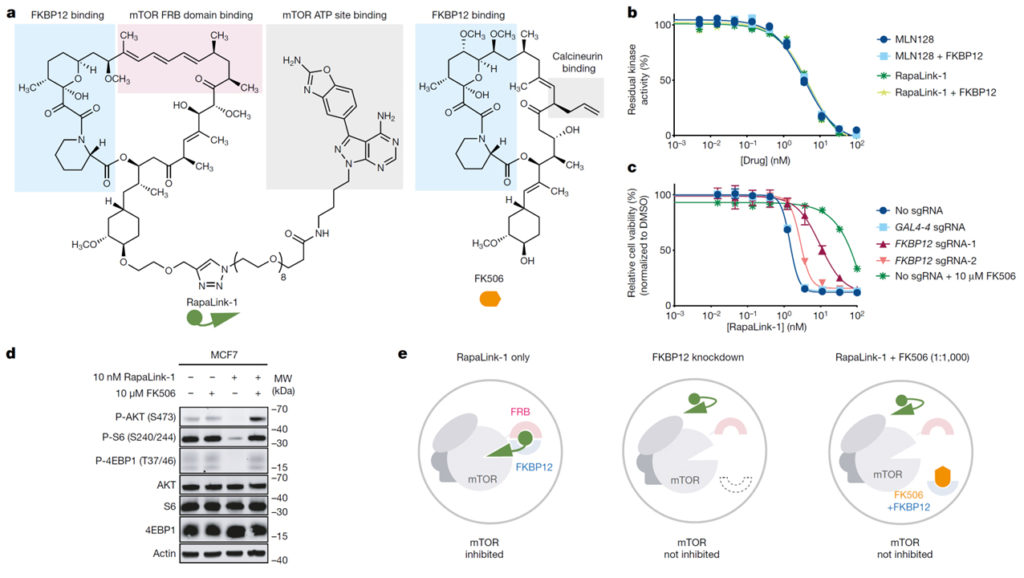
Fig 1. RapaLink-1은 FKBP12의 cellular activity를 이용하여 mTOR의 억제제로 작용할 가능성이 있다.
a, RapaLink-1와 FK506의 화학 구조.
b, FKBP12 존재 여부와 MLN128, RapaLink-1, rapamycin에 의한 mTOR 활성 억제에 대한 in vitro kinase assay 결과.
c, GAL4-4 (control)과 FKBP12을 target으로 하는 sgRNA를 도입 후 RapaLink-1 72시간 처리한 후 cell viability 결과.
d, MCF7 cell에서 RapaLink-1, FK506을 각각 또는 조합하여 처리한 후 mTOR pathway western blot 진행 결과.
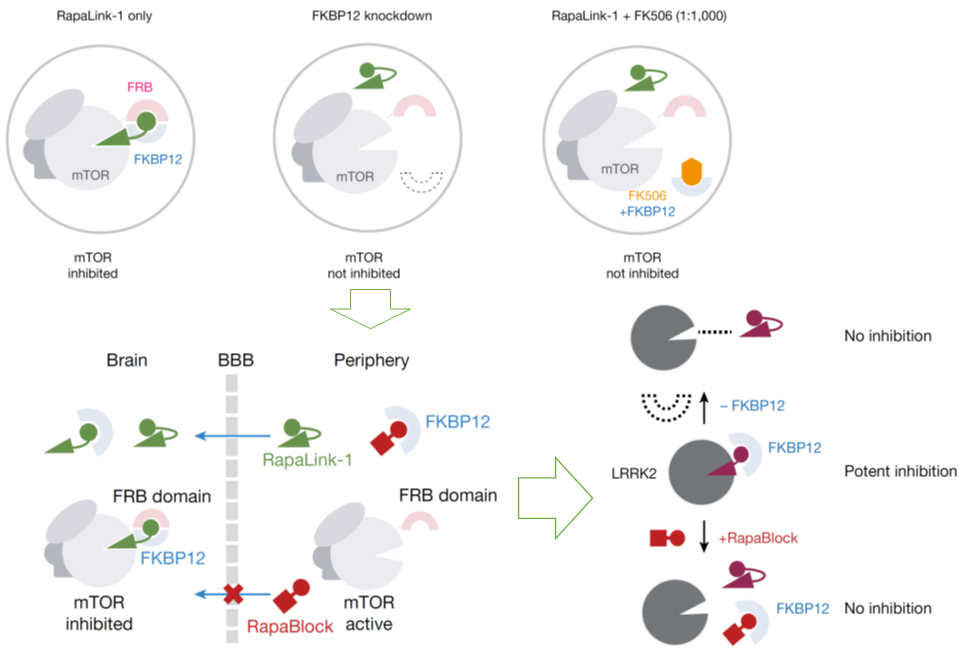
e, 전체 모델의 개략도
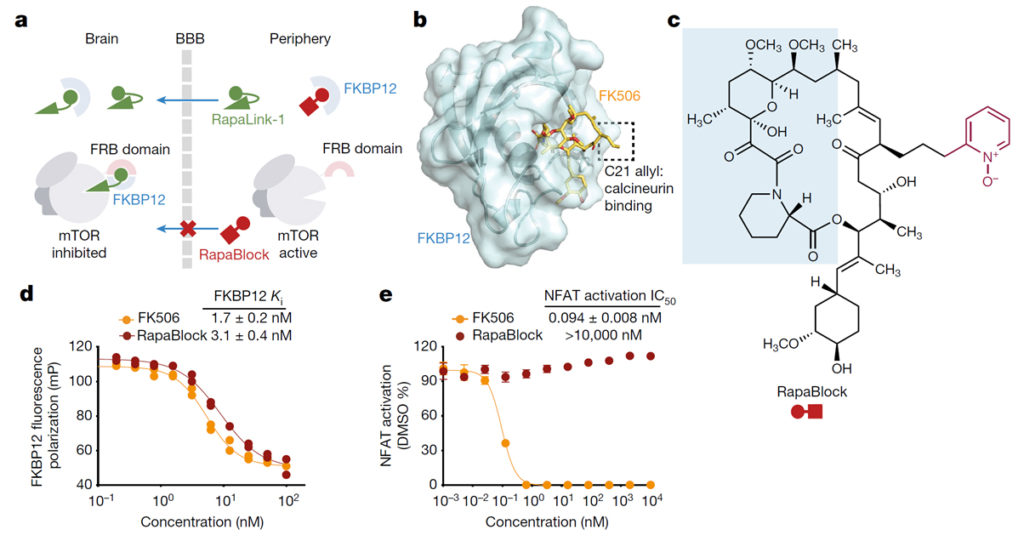
Fig 2. RapaBlock은 non-immunosuppressive 한 FKBP12의 ligand이다.
a, 뇌 특이적 mTOR 억제를 위한 RapaLink-1과 RapaBlock 조합 모델.
b, FK506–FKBP12 공결정 구조(PDB: 1FKJ)는 C21 알릴기가 용매에 노출되어 있고 그 변형이 칼시뉴린 결합을 없앨 수 있음을 보여줍니다.
b, FK506-FKBP12 결정 구조. C21 allyl이 노출된 모습.
c, RapaBlock의 화학 구조. 파란색 영역은 FKBP12 결합 부분. 보라색 부분은 FK506에 대한 화학적 변형.
d, fluoresceinlabelled rapamycin을 tracer로 사용한 Competition fluorescence polarization assay.
e, Luciferase를 발현하는 Jurkat에서 확인한 NFAT transcription response.
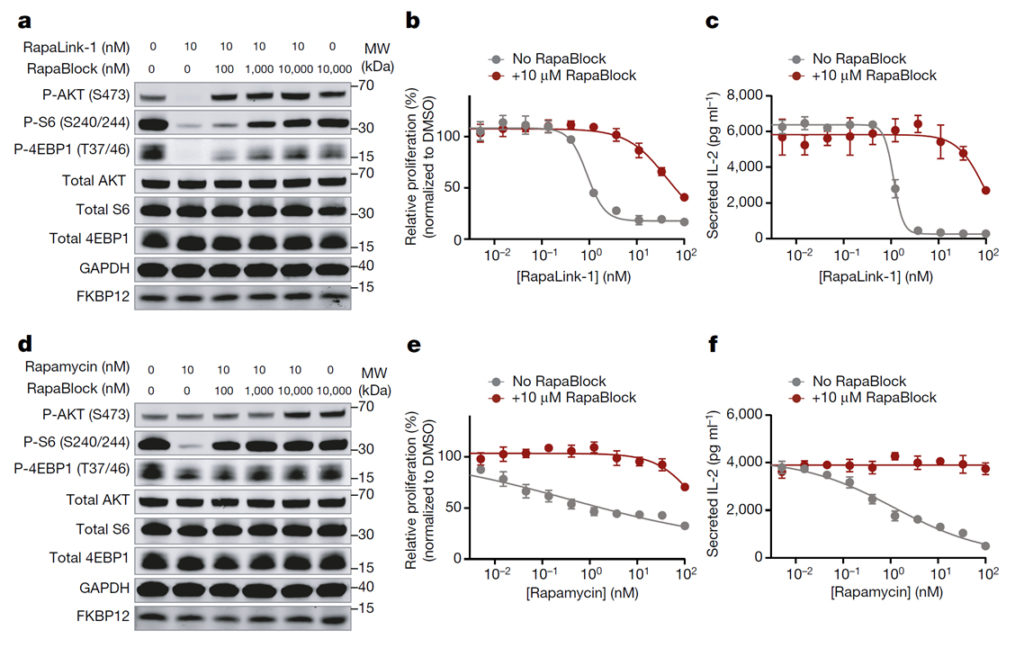
Fig 3. RapaBlock은 RapaLink-1과 rapamycin에 의한 mTOR 억제로부터 세포들을 보호한다.
a, MCF7에서 RapaLink-1과 RapaBlock을 조합하여 처리한 mTOR pathway western blot 결과.
b, Human PBMC에서 RapaLink-1과 RapaBlock을 조합하여 처리한 후 확인한 세포 증식 정도.
c, Human PBMC에서 RapaLink-1과 RapaBlock을 조합하여 처리한 후 확인한 ELISA 결과.
d, MCF7에서 Rapamycin과 RapaBlock을 조합하여 처리한 mTOR pathway western blot 결과.
e, Human PBMC에서 Rapamycin과 RapaBlock을 조합하여 처리한 후 확인한 세포 증식 정도.
f, Human PBMC에서 Rapamycin과 RapaBlock을 조합하여 처리한 후 확인한 ELISA 결과.
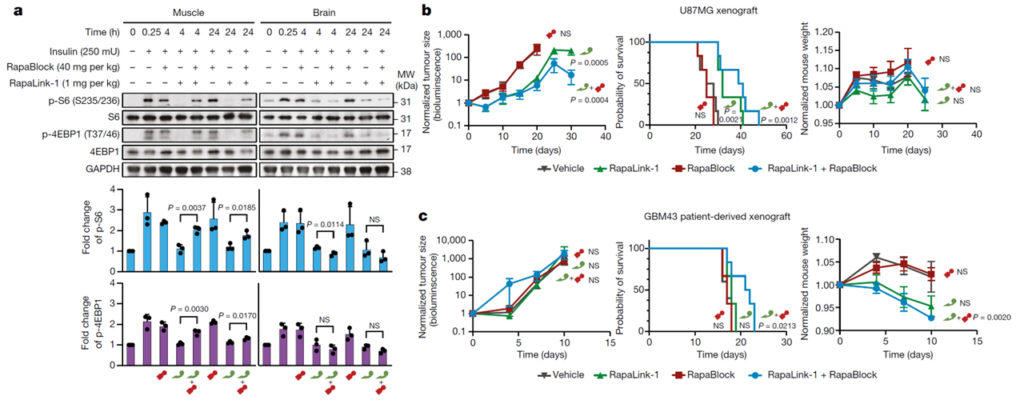
Fig 4. RapaLink-1과 RapaBlock을 같이 처리하면 뇌 특이적 mTOR 억제를 할 수 있다.
a, Mouse skeletal muscle과 brain에서 RapaLink-1, RapaBlock을 각각 또는 조합하여 처리한 후 mTOR pathway에 대한 western blot 결과.
b, Luciferase-expressing orthotopic glioblastoma를 xenografts (U87MG) 한 mouse에 RapaBlock, RapaLink-1을 각각 또는 조합하여 처리한 후 tumor size, 생존률을 확인한 결과.
c, Luciferase-expressing orthotopic glioblastoma를 xenografts (GBM43) 한 mouse에 RapaBlock, RapaLink-1을 각각 또는 조합하여 처리한 후 tumor size, 생존률을 확인한 결과.
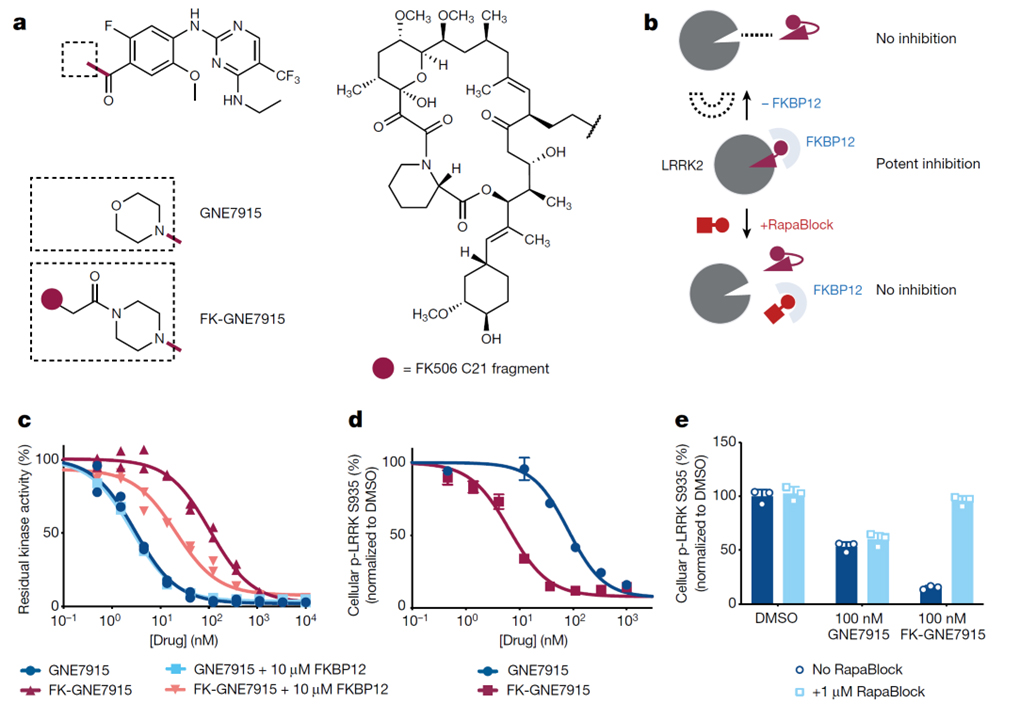
Fig 5. FKBP-dependent kinase inhibitors와 RapaBlock을 통한 프로그램 가능한 kinase 억제 시스템.
a, GNE7915와 FK-GNE7915의 구조.
b, FKBP-dependent kinase inhibitors의 작용 모델.
c, FKBP12 단백질 존재 여부에 따른 kinase 억제 정도.
d, RAW264.7 세포에 GNE7915, FK-GNE7915을 각각 처리하고 LRRK2 phosphorylation을 확인한 결과.
e, RAW264.7 세포에 GNE7915, FK-GNE7915을 각각 또는 RapaBlock과 조합하여 처리하고 LRRK2 phosphorylation을 확인한 결과.
Conclusion
우리는 FKBP12에 대한 rapamycin analogue의 고유한 기능적 의존성을 활용하여 강력한 mTOR 억제제 (RapaLink-1)와 FKBP12의 세포 투과성, BBB-불투과성 ligand의 동시 투여를 통해 뇌 특이적 mTOR 억제를 달성하는 접근법을 개발했습니다. (RapaBlock). 이 binary pharmacology 전략에 의해 활성화된 조직 제한 mTOR 억제는 말초 조직의 독성을 감소시켰지만 glioblastoma xenograft 모델에서 RapaLink-1의 치료 효과를 유지했습니다. 이 결과를 기초로 동일한 약물 조합이 알코올 중독과 같이 mTOR 활성이 조절되지 않아 유발되는 다른 CNS 질환에서 더 큰 가치를 가질 수 있습니다.
우리의 방법은 mTOR 억제를 넘어 적용될 가능성도 있습니다. 우리는 용매에 노출된 그룹을 통해 ATP-site kinase inhibitors를 FK506에 화학적으로 연결하면 활성이 풍부한 endogenous protein FKBP12에 의존하는 새로운 종류의 세포 투과성 kinase inhibitors를 만들 수 있다는 것을 보여줍니다. 이러한 억제제는 약물, target kinase, FKBP12의 삼원 복합체 형성을 매개하는 능력과 RapaBlock에 의한 활성 조절에 대한 순응성이 있습니다. 이러한 화합물을 사례별로 평가하고 최적화하려면 추가적인 in vivo 연구와 medicinal chemistry가 필요하지만 우리의 조사에 따르면 FKBP-dependent kinase inhibitors (FK-GNE7915)와 RapaBlock을 사용하여 LRRK2를 뇌 선택적으로 억제하는 것이 가능합니다. 우리는 RapaBlock이 RapaLink-1과 다른 FKBP12-dependent kinase inhibitors의 세포 활성을 제어하는 메커니즘을 조사했습니다. 우리의 현재 데이터는 RapaLink-1(와 다른 FKBP12 결합 화합물)의 기능에서 cellular FKBP12의 역할을 최소 두 가지 밝혀냈습니다. 첫째, 우리는 FKBP12가 세포 내부에 RapaLink-1을 보유하고 축적하여 세포 농도를 높이는 저장소 역할을 한다는 것을 보여주었습니다. 둘째, 우리가 조사한 대부분의 FKBP12-dependent kinase inhibitors의 경우 FKBP12는 cell-free assay에서 효능을 향상시킵니다. 우리는 직접적인 증거를 얻지 못했지만 수용액에서 소수성 약품 사이에 유연한 링커로 구축된 bifunctional compound가 주로 결합 불능 구조가 되면서 수화 패널티(‘소수성 붕괴’)를 최소화하고 FKBP12의 결합이 노출됨으로 인해 표적 억제를 가능도록 만들 것이라고 예상합니다. RapaBlock은 FKBP12의 ligand 결합 부위를 점유하여 이 두 가지 과정을 모두 방해합니다. 이런 고분자 화합물이 세포로 들어가는 방법과 FKBP12가 표적 단백질과의 결합 상호작용에 관여하는지 여부를 설명하기 위해서는 추가 연구가 필요하지만, 우리는 이 시스템이 kinase 억제에 대한 일반화 가능한 접근 방식을 제공할 수 있을 것이라 생각합니다. 조직 선택적 치료 효과를 달성하기 위해 두 가지 약제를 결합하는 것은 이전에 임상 용도로 승인되었거나 개발 중인 약물에도 사용되었습니다. 예로는 파킨슨병에 대한 levodopa–carbidopa (BBB-permeable dopamine precursor–BBB-impermeable DOPA decarboxylase inhibitor), 폐경후 일과성 열감에 대한 oestrogens–bazedoxifene (BBB-permeable oestrogen–BBB-impermeable oestrogen receptor modulator)가 있고 알츠하이머에 대해서는 donepezil–solifenacin (BBB-permeable acetylcholinesterase inhibitor–BBB-impermeable anticholinergic)을 사용합니다. 우리의 접근 방식은 동일한 표적이나 경로에 중화 효과가 있는 두 가지 약물을 사용하지 않는다는 점에서 선례들과는 다릅니다. 대신, RapaBlock은 kinase 억제제의 활성을 직접적으로 약화시켜 조직 특이성을 제어합니다. 따라서 이 시스템은 invariant RapaBlock 분자와 FK506, 납 화합물의 구조를 기반으로 쉽게 설계할 수 있어 FKBP12-dependent inhibitors만 필요로 하는 다수의 표적에 적용할 수 있습니다. 우리는 이 연구에서 protein kinase에 초점을 맞추었지만 이 접근 방식이 GTPase, 히스톤 변형 효소와 같은 다른 종류의 표적에도 적용될 수 있다고 생각합니다.