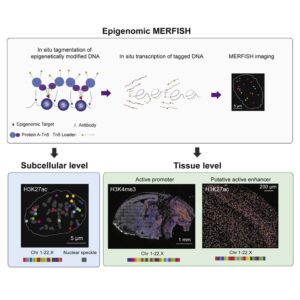
human immune cells에 대한 Biofilm formation은 Vibrio cholerae의multicellular predation strategy입니다.
Abstract
Biofilm formation은 일반적으로 antibiotics, bacteriophages, and leukocytes of the human immune system 등 environmental threats에 대한 bacterial defense mechanism으로 알려져 있습니다.
이 연구에서는 human pathogen인 Vibrio cholerae의 경우 biofilm formation이 보호 특성일 뿐만 아니라 다른 immune cells를 집단적으로 공격하는 공격적인 특성임을 보여줍니다. V. cholerae는 주로 mannose-sensitive hemagglutinin pili, toxin-coregulated pili, secreted colonization factor TcpF로 구성된 matrix composition를 사용하여 eukaryotic cell surface에 biofilms을 형성하는데, 이는 다른 표면에 형성되는 biofilms의 매트릭스 구성과 차이가 있습니다. 이러한 biofilms은 immune cells를 감싸고 secreted hemolysin의 높은 local concentration를 형성하여 biofilms이 c-di-GMP-dependent manner로 분산되기 전에 immune cells를 사멸시킵니다. 이러한 결과를 종합하면 bacteria가 multicellular strategy로 biofilms formation을 사용하여 사냥꾼인 인간 immune cells와 사냥감인 bacteria 간의 일반적인 관계를 뒤집는 방법을 밝혀냈습니다.
Figure
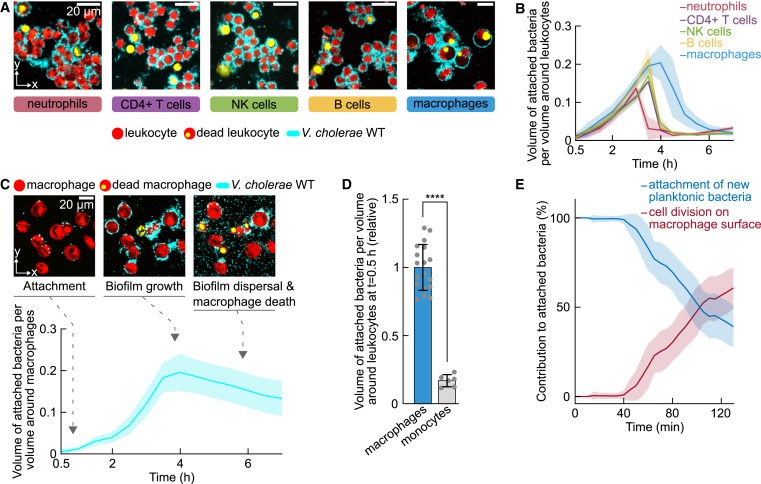
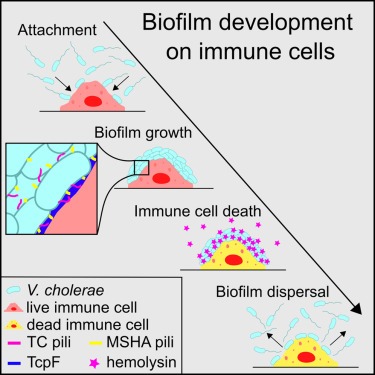
Figure 1. V. cholerae는 human leukocytes에 biofilms을 형성한 후 immune cell death와 biofilm dispersal가 이어집니다.
(A) V. cholerae cell은 혈액에서 분리한 다양한 유형의 human leukocytes에 부착하여 leukocytes가 죽고 bacteria가 immune cell surface에서 집단적으로 흩어지기 전에 biofilms을 형성합니다.
(B) leukocytes에 대한 Bacterial attachment은 confocal images에서 측정되었습니다
(C) V. cholerae cell은 monocytic THP-1 cell line에서 유래한 macrophages에 biofilms을 형성한 후 biofilms이 분산되고 macrophages가 사멸합니다.
(D) 30분 co-incubation 후 측정한 결과, THP-1 monocytes의 경우 THP-1-derived macrophages와 비교하여 eukaryotic surface에 대한 V. cholerae Attachment가 크게 감소합니다.
(E) new planktonic cells의 attachment 또는 이미 macrophage surface에 부착된 bacteria의 division으로 인해 macrophages 표면에 bacterial accumulation되는 것을 정량화.
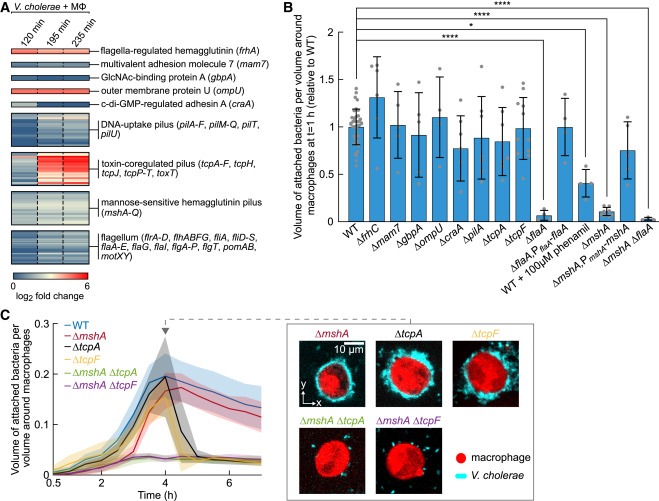
Figure 2. V. cholerae가 macrophages surface에 부착되는 것은 type IV pili에 의해 활성화됩니다.
(A) bacteria and macrophages (Mφ)의 co-incubation 중 서로 다른 시점에서, macrophages에 부착된 V. cholerae의 transcriptional changes를 RNA-seq을 사용하여 측정했습니다.
(B) different surfaces에 attachment에 필요한 유전자가 결여된 V. cholerae deletion mutants와 1시간 동안 co-incubation한 후 macrophage에 bacterial attachment 양을 정량화.
(C) MSHA pili(ΔmshA)를 생산할 수 없는 V. cholerae cell은 장기간 co-incubation 후 결국 macrophages에 부착되며, 이는 TC pili와 secreted protein TcpF에 의존합니다.
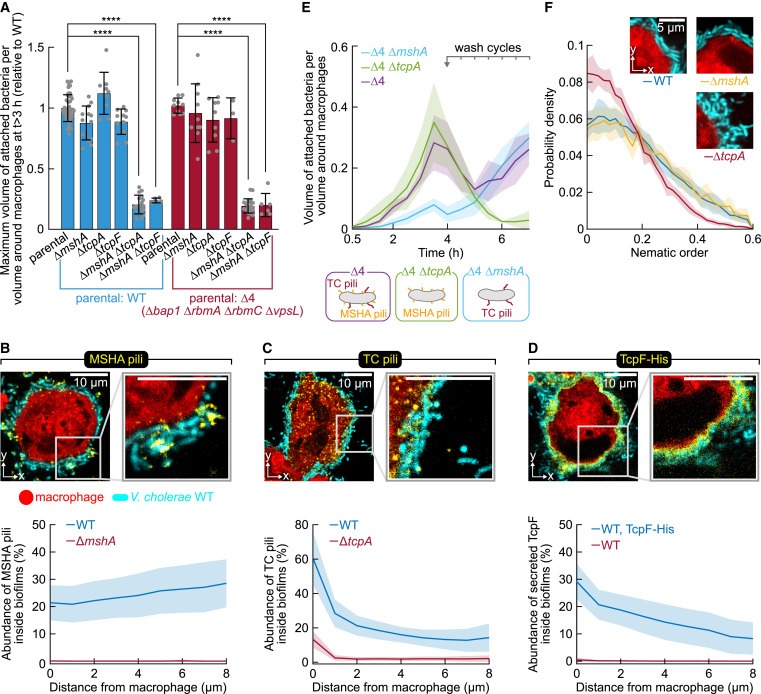
Figure 3. macrophages에 형성된 biofilms의 extracellular matrix는 MSHA pili, TC pili 및 TcpF로 구성되며, 이들은 서로 다른 biofilm 기능을 제공합니다.
(A) macrophages surface에서 V. cholerae biofilm이 성장하려면 MSHA pili 또는 TC pili(together with TcpF)의 생성이 필요하지만, abiotic surfaces에 형성되는 biofilms에 필수적인 matrix components에는 의존하지 않습니다:
(B-D) 4시간 co-incubation 후 측정한 macrophages에 형성된 biofilm 내부의 MSHA pili(B), TC pili(C), TcpF(D)의 Localization and abundance.
(E) TC pili의 생성은 biofilms에 mechanical stability를 제공합니다: V. cholerae-macrophage interaction dynamics 동안 medium exchange를 반복하면 macrophage surface에서 TC pili가 없는 biofilms이 지속적으로 제거됩니다.
(F) TC pili의 Production은 biofilm compactness에 영향을 미칩니다: single-cell resolution analysis 결과, ΔtcpA mutants는 nematic order parameter의 분포 측면에서 측정된 lower cell-cell alignment biofilms을 생성하는 것으로 밝혀졌습니다.
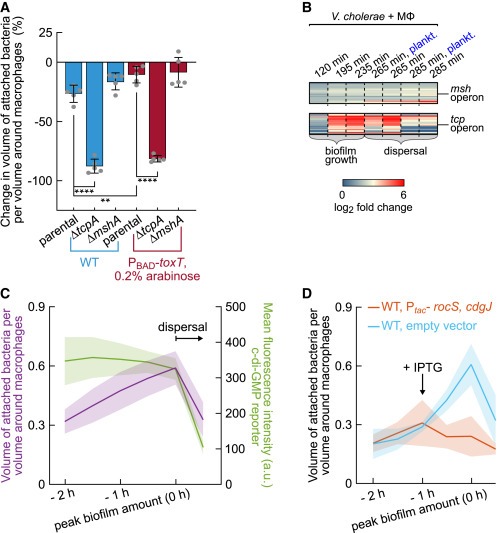
Figure 4. Biofilm dispersal은 intracellular c-di-GMP levels과 TC pili의 존재에 의해 결정됩니다.
(A) V. cholerae biofilms의 biofilm matrix에 TC pili의 존재는 macrophage surface으로부터의 biofilm dispersal에 영향을 미칩니다.
(B) macrophages와 상호작용하는 동안 V. cholerae에 transcriptome dynamics를 분석한 결과, TC pili를 암호화하는 유전자가 biofilm growth 중에 상향 조절되는 것으로 나타났습니다.
(C) biofilm growth and dispersal 중 fluorescent reporter (based on an unstable GFP, green line)를 사용하여 intracellular c-di-GMP levels을 측정하고 macrophage당 부착된 bacteria를 동시에 측정(보라색 선)한 결과.
(D) IPTG-inducible Ptac promoter의 제어하에 두 개의 c-di-GMP-degrading phosphodiesterases RocS 및 CdgJ의 overexpression을 유도하면 biofilm dispersal이 발생합니다(주황색 선).
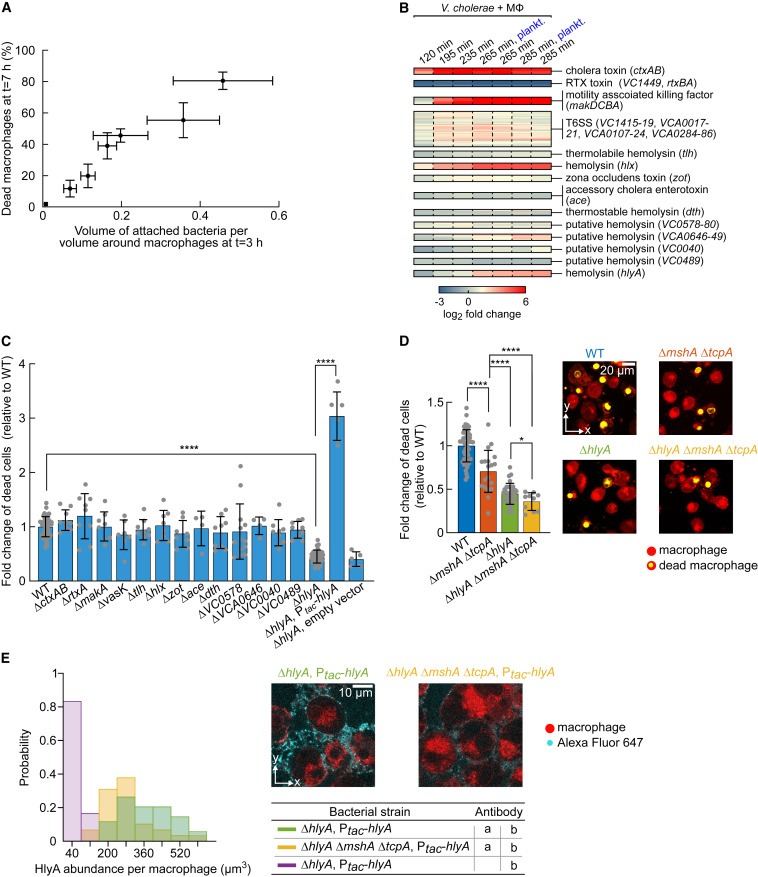
Figure 5. bacterial biofilms에 의한 macrophages의 Encapsulation은 macrophages의 cell death를 증가시킵니다.
(A) immune cell surface의 V. cholerae에 WT biofilm 양이 증가함에 따라 죽은 macrophages의 비율이 증가합니다.
(B) V. cholerae를 THP-1-derived macrophages (Mφ)와 co-incubation하는 동안 서로 다른 시점에 RNA-seq 측정을 수행했습니다.
(C) known or putative toxins production에 필요한 유전자가 없는 V. cholerae strains과 7시간 동안 co-incubation한 후 microscopy and propidium iodide staining을 사용하여 Macrophage 사멸을 측정했습니다.
(D) Biofilm formation은 V. cholerae-induced macrophage death에 기여합니다.
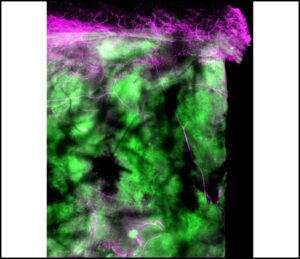
(E) HlyA의 Immunofluorescence staining (representative confocal images의 청록색)은 biofilms이 non-biofilm producing bacteria에 비해 macrophage surface 근처에서 높은 HlyA toxin abundance를 형성함을 보여줍니다.
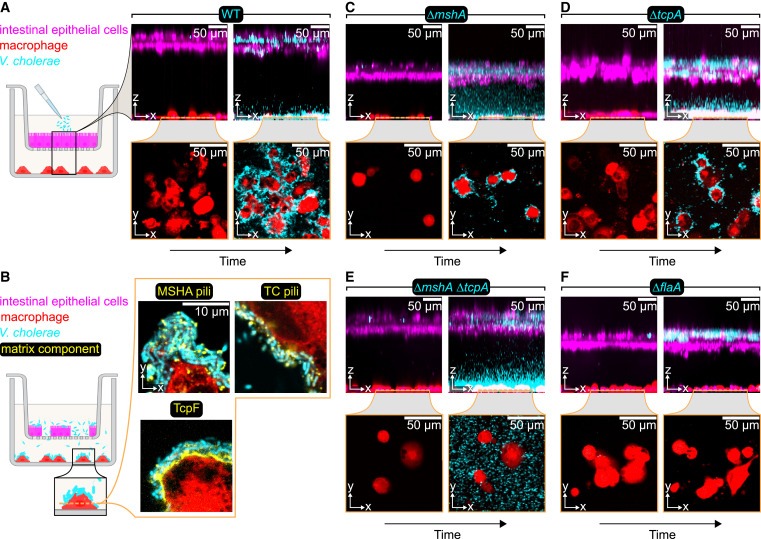
Figure 6. V. cholerae cells은 human intestinal epithelial barrier를 파괴하고 macrophages underneath에 biofilms을 형성합니다.
(A) Differentiated human enteroid monolayers (donor #1)을 permeable membrane insert (3μm pore size)에서 배양하고 실험 설정의 개략도에 표시된 대로 THP-1 macrophages 위에 배치했습니다.
(B) enteroid monolayers, macrophages, and bacteria의 co-culture 중 macrophages에 형성된 inside V. cholerae biofilms 서 fluorescently conjugated antibodies (노란색으로 표시)를 사용하여 MSHA pili, TC pili, TcpF를 시각화한 결과입니다.
(C-F) 서로 다른 V. cholerae mutants에 감염된 enteroid monolayers and macrophages의 Co-culture.
Disscussion
우리의 연구에 따르면 V. cholerae는 다양한 human immune cells의 surface에 biofilm을 형성하고 immune cells를 감싸고 있습니다. 우리는 enteroid infection model에서 immune cells에 대한 biofilm 형성이 epithelial barrier를 뚫은 후에 발생한다는 것을 발견했습니다. 또한 immune cells의 biofilm formation은 광범위한 과정이지만, monocytes에서는 관찰되지 않고 neutrophils, NK cells, CD4+ T cells, B cells, and macrophages에서 관찰되었기 때문에 untargeted process는 아닙니다. 이번 분석을 통해 immune cells에서 biofilm의 여러 단계를 제어하는 메커니즘과 immune cells에서 biofilm의 기능이라는 두 가지 근본적인 측면이 밝혀졌습니다.
macrophages의 biofilm 발달에는 bacterial attachment, matrix production, and three-dimensional growth, as well as biofilm dispersal이 포함되며, 이는 abiotic surfaces의 biofilm 발달과 질적으로 유사합니다. 그러나 macrophages의 biofilm 발달에 관여하는 메커니즘은 다른 표면의 biofilm 발달과는 다르다는 것을 보여주었습니다.
glass, agar, and chitin에 있는 V. cholerae의 biofilm matrix는 주로 polysaccharide VPS와 proteins RbmA, RbmC, Bap1로 구성됩니다. intestinal epithelial cells에서 V. cholerae은 세포가 TC pili에 의해 서로 결합된 microaggregates를 형성할 수 있습니다. suspensions에서 V. cholerae는 TC pilus DNA-uptake pilus를 사용하여 multicellular clumps로 auto-aggregate할 수 있으며, 이는 bacterial growth이 필요하지 않은 과정입니다. 이와 대조적으로, macrophages에서 성장한 biofilm은 MSHA pili, TP pili, and TcpF로 구성된 matrix를 형성하며, canonical matrix components인 VPS, RbmA, RbmC, Bap1은 dispensable 상태임을 보여주었습니다. 우리는 type IV pili가 급성 감염 시 V. cholerae에 대한 편리한 biofilm matrix components라고 추측하는데, 이는 이러한 pili가 빠르게 조립 및 수축되어 잠재적으로 biofilm의 빠른 assembled and retracted을 가능하게 할 수 있기 때문입니다. 서로 다른 환경에서 서로 다른 matrix components를 biofilm에 활용하는 것은 bacteria의 흥미로운 적응입니다.
biofilm matrix composition의 차이 외에도 macrophages의 surface attachment는 다른 표면과 비교하여 다릅니다. glass and chitin surfaces에 부착하려면 flagella와 MSHA pili가 필요합니다. epithelial cells에 부착하려면 TC pili와 TcpF, 그리고 adhesins GbpA, FrhA, OmpU, Mam7이 필요합니다. 반면, V. cholerae가 macrophages에 부착할 때는 adhesins GbpA, FrhA, OmpU, Mam7이 관련이 없는 것으로 밝혀졌습니다. 대신 flagella, bacterial motility, secreted colonization factor TcpF와 함께 two type IV pili: MSHA pili 또는 TC pili 중 하나 이상에 의존하여 macrophages에 부착합니다. 두 가지 pili가 모두 결여된 Bacterial strains (ΔmshA ΔtcpA)는 macrophages에 부착할 수 없지만 epithelial cells에는 부착할 수 있습니다.
macrophages에서 biofilm의 기능은 다른 표면에서 biofilm의 기능에 대한 일반적인 해석과도 다릅니다. biofilm formation은 종종 스트레스에 대한 내성을 높이고 포식자의 bacterial population 접근을 억제하여 constituent cells을 보호합니다. 대조적으로, 우리는 macrophages에 biofilm이 형성되면 macrophages 주변에 locally high concentration의 secreted toxin HlyA를 형성하여 macrophages의 사멸을 향상시킨다는 것을 보여줍니다. 흥미롭게도 V. cholerae는 마우스 모델에서 toxin-dependent manner로 neutrophils의 박멸을 회피하는 것으로 나타났으며, 본 연구는 이러한 immune cells의 biofilm formation이 효율적인 toxin delivery에 중요할 수 있음을 시사합니다. Pseudomonas aeruginosa (P. aeruginosa)의 경우, planktonic cells와 biofilm의 세포에서 분비되는 rhamnolipids이 immune cells, 특히 immune cells가 성숙한 P. aeruginosa biofilm을 향해 활발하게 이동할 때 immune cells를 죽일 수 있다는 것이 이전에 관찰되었습니다. 대조적으로, 우리의 연구에 따르면 V. cholerae는 immune cells 위와 주변에 biofilm을 형성하여 immune cells와 직접 상호 작용하여 궁극적으로 immune cells가 죽는다는 것을 보여줍니다. 따라서 V. cholerae가 immune cells와 그 주변에 형성하는 biofilm과 immune cells에 biofilm-dependent enhanced toxin delivery하는 것은 이전에 설명한 bacteria와 immune cells 간의 상호작용 과정과는 질적으로 다릅니다. 많은 bacterial pathogens이 감염 중에 biofilm을 형성할 수 있지만, immune cells에 대한 biofilm 형성이 다른 pathogens들 사이에서 얼마나 널리 퍼져 있는지, immune cells의 biofilm이 toxin delivery and predation enhancing 외에 다른 기능을 가질 수 있는지 여부는 아직 조사해야 할 사항입니다.
cholerae에 감염되면 inflammatory response을 일으켜 subsequent infections에 대한 면역력이 오래 지속됩니다. 또한 cholerae 환자의 혈액에서 anti-MSHA antibodies가 발견되는데, MSHA pili가 cholerae 발병에 관여하는 것으로 알려지지 않아 지금까지 미스터리로 남아있었습니다. 실제로 V. cholerae은 intestinal colonization early phase에서 분비되는 mucosal immune factor인 IgA에 의해 인식되지 않도록 MSHA pili 생성을 억제하여 mucus layer을 통한 bacteria 침투와 이후 상epithelial cells에 결합하는 것을 방지해야 합니다. V. cholerae에 대한 epithelial cells와 V. cholerae에 감염의 다양한 동물 모델과의 상호 작용 연구는 host colonization 동안 함께 작용하는 요인으로 TC pili와 TcpF를 확인했지만 MSHA pili의 부족은 colonization 능력에 영향을 미치지 않았습니다. 이제 우리의 데이터는 immune cells에 부착하고 immune cells의 biofilm matrix의 일부로서 MSHA pili의 중요한 역할을 밝혀 V. cholerae에 감염시 anti-MSHA antibodies의 존재를 설명할 수 있는 것으로 나타났습니다. 또한, 우리의 연구 결과는 immune cells와의 상호 작용에 관여하기 때문에 감염 중 TC pili 및 TcpF의 중요성에 대한 추가적인 측면을 제공합니다.
결론적으로, V. cholerae는 bacteria가 감염 부위의 immune cells를 죽이기 위해 집단적으로 작용하여 주변의 phagocytes 수를 감소시키는 메커니즘을 개발했습니다. 따라서 V. cholerae에는 다른 bacteria처럼 immune cells를 피하기 위해 biofilm formation을 피난처로 사용하지 않습니다. 대신, V. cholerae는 immune cells보다 먼저 aggressive multicellular strategy로 biofilm formation을 사용합니다.