Bat pluripotent stem cell은 숙주와 바이러스 사이의 비정상적인 얽힘을 밝혀낸다.
Abstract
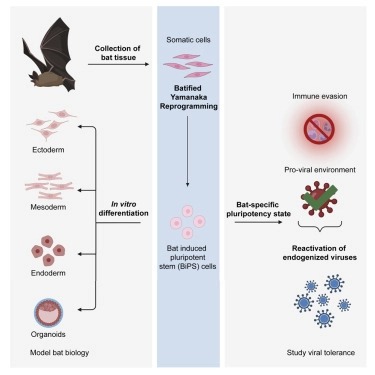
박쥐는 날 수 있고, laryngeal echolocation를 사용하며, 바이러스를 견딜 수 있기 때문에 포유류에서 독특하다. 그러나 현재 박쥐의 생물학이나 바이러스 감염에 대한 반응을 연구하기 위한 믿을 만한 세포 모델은 없다.
여기서 우리는 wild greater horseshoe bat (Rhinolophus ferumquinum와 greater mouse-eared bat (Myotis myotis)라는 두 종의 박쥐로부터 induced pluripotent stem cell (iPSC)를 만들었다. 두 박쥐 종의 iPSC는 유사한 특성을 보였고 바이러스에 의해 공격받은 세포와 유사한 유전자 발현 프로파일을 가지고 있었다. 그들은 또한 많은 수의 endogenous viral sequences, 특히 retrovirus를 가지고 있었다. 이러한 결과는 박쥐가 많은 양의 바이러스 서열을 견딜 수 있는 메커니즘을 진화시켰으며 이전에 생각했던 것보다 바이러스와 더 얽히고설킨 관계를 가질 수 있음을 시사한다. 박쥐 iPSC와 그들의 differentiated progeny에 대한 추가적인 연구는 박쥐 생물학, 바이러스 숙주 관계, 박쥐의 특별한 특성의 분자 기반에 대한 통찰력을 제공할 것이다.
Figure
Figure 1. pluripotent Rhinolophus ferrumequinum bat stem cell의 derivation.
(A) bat pluripotent stem cell derivation strategy.
(B) mouse embryonic fibroblasts에서 성장한 확립된 BiPS cell colonies의 형태를 보여주는 다양한 배율의 bat pluripotent stem cell의 Microscopic image.
(C) prominent cytoplasmic vesicles을 강조하는 BiPS 세포의 Differential interference contrast microscopy image.
(D) BiPS 세포에서 Oct4의 Immunofluorescent detection.
(E) bat embryonic fibroblast (BEF)와 pluripotent stem cells (BiPS) 사이의 transcriptional difference 를 보여주는 RNA-seq 데이터의 MA plot.
(F) BEF 또는 BiPS 세포에서 얻은 ATAC-seq 신호의 Kmean cluster analysis.
(G) BEF 및 BiPS 셀에서 얻은 RRBS 결과의 Density plot.
(H) 그림과 같이 BEF 또는 BiPS 세포에서 ChIP-seq 후에 K4(activating chromatin modification) 또는 K27(repressing chromatin modification)에서 histone 3 methylation status의 Scatter plot.
(I) BiPS 세포에서 bivalent chromatin sites의 발생을 보여주는 BiPS 세포에서 H3K4me3와 H3K27me3의 Scatter plot correlation.
(J) RNA-seq, ATAC-seq 및 H3K4me3 또는 H3K27me3 ChIP-seq는 BEF 세포와 비교할 때 BiPS에서 활성화(Nanog, Kit)되거나 억제(Thy1)되는 알려진 역할을 가진 선택된 유전자의 신호이다.
Figure 3 R. ferrumequinum bat pluripotent stem cell의 분화 가능성.
(A) 각각 ectoderm, endoderm, or mesoderm으로의 특이적 분화 후 ineage-specific markers Pax6, Afp, or brachyury (T)의 발현을 검출하는 antibodies로 염색한 후 Immunofluorescence microscopy image.
(B) (A)에서와 같이 three germ layer 모두에 특이적인 마커를 검출하기 위해 antibodies로 염색된 BiPS 세포의 3D- differentiation 후 형성된 embryonic bodies (EB)의 Immunofluorescence image.
(C) (A)에서와 같이 monolayer differentiation 또는 (B)에서와 같이 embryonic body differentiation를 겪은 BiPS 세포에서 선택된 lineage-specific marker gene의 RNA-seq signal.
(D) ectodermal (왼쪽), mesodermal (중간) 및 mesodermal (오른쪽) 특징을 나타내는 immunocompromised 마우스에 BiPS 세포를 주입한 후 종양 조직의 hematoxylin-eosin-stained section의 Microscopic image.
(E) Bmp4에 노출된 후 Bmp4에 노출된 후 BiPS 세포에서 얻은 부동 배반의 이미지로 위상차 현미경(왼쪽)으로 형태를 캡처하고 면역형광 염색 후 내부 세포 덩어리 같은 세포 클러스터에서 Oct4 발현을 감지합니다(중간, 오른쪽) ).
BiPS 세포가 Bmp4에 노출된 후 얻어진 부유하는 blastoids 의 형태를 phase-contrast microscopy로 찍은 image (왼쪽), immunofluorescence staining을 통해 inner-cell mass-like cell cluster에서 Oct4 발현을 감지한 image (중앙, 우측).
(F) (E)에서와 같이 Bmp4-induced differentiation 동안 cell culture vessel surface에 blastoids가 부착된 후에 형성되는 전형적인 blastocyst-outgrowth-like cell cluster의 Phase-contrast microscopy image.
Figure 4. induced pluripotent stem cells derived Myotis myotis uropatagium fibroblasts의 특성화.
(A) Myotis myotis iPS 세포의 Phase contrast image.
(B) pluripotency marker Oct4를 검출하기 위한 immunostaining 후 Myotis myotis iPS 세포의 Microscopic image.
(C) naive (Tfe3 및 Tfcp2l1) 또는 primed pluripotency (Zic2 및 Otx2)의 marker staining 후 Myotis myotis pluripotent stem cell의 Immunofluorescence image.
(D) 각각 ectoderm, mesoderm, and endoderm에 대한 마커로서 Pax6, brachyury(T) 및 Afp를 검출하기 위해 differentiation 및 immunostaining을 거친 Myotis myotis iPS 세포의 Microscopic image.
Figure 5. bat pluripotent stem cell의 특징.
(A) 다른 종에서 유래한 ips cell과 비교한 R. ferrumequinum induced pluripotent bat stem cells (BiPS)의 Principal component analysis.
(B) principal component 1(PC1)의 일부로서 pluripotent bat and mouse stem cell의 차이에 기여하는 genes Plot. 밝은 파란색으로 강조 표시된 것은 PC1 기여 유전자의 상위 5%로 구성된 “leading edge”.
(C) (B)에 정의된 PC1-contributing genes/leading-edge gene의 상위 5% 중에서 유의하게 enriched된 것으로 확인된 Selected GO 및 (D) KEG 경로를 odds ratio로 표시하였으며, 각 원의 색상은 농축 p 값을 나타내고 크기는 각 범주에 존재하는 유전자의 수를 나타낸다.
(D) R. ferrumequinum lineage의 comparative genomics에 의한 leading-edge gene의 Selection analyses는 positive selection의 중요한 증거가 되는 8개의 유전자 (AARD, COL3A1, FAM111A, LAMB3, MUC1*, NES*, RGS5, RSPH1*)만 확인했으며, 그 중 5개는 는 alignment region에서 가능성이 높은 BEB site를 하나 이상 보여 주었지만 3개의 유전자(*로 지정)는 그렇지 않았습니다(표 S5E 참조).
Figure 6. bat induced pluripotent stem cell에서 endogenized retroviral element의 활성화.
(A) R. ferrumequinum 게놈에 매핑된 RNA-seq reads와 알려진 매핑된 ERV 요소 사이의 overlap 을 추출하여 결정된 R. ferrumequinum bat embryonic fibroblasts (BEF) 및 iPS 세포(BiPS)에서 표시된 ERV elements 의 발현.
(B) R. ferrumequinum 게놈에 정렬된 identified full-length retrovirus sequence인 RFe-V-MD1에 대한 RNA 및 Iso-seq sequencing track.
(C) human 293FT(kidney tumor cells) 및 human embryonic stem cells (H9), mouse 3T3(fibroblasts) 및 mouse embryonic stem cell (R1) 및 R. ferrumequinum bat induced pluripotent stem cell (BiPS), endogenous retrovirus (ERV)-specific HERV K Cap antibody 로부터의 protein lysate의 Western blotting.
(D) endogenous retrovirus (ERV) HERV K Cap protein 검출 후 R. ferrumequinum(RFe) bat embryonic fibroblasts (BEF) 및 iPS 세포(상단) 및 M. myotis(MMy) bat uropatagium fibroblasts (BUF) 및 iPS 세포(하단)의 Immunofluorescence images.
(E) R. ferrumequinum bat pluripotent stem cell의 transmission electron microscopy의 개요.
(F) endogenous retrovirus-like particle의 출현과 형태학적으로 호환되는 aggregates의 존재를 보여주는 (E)와 같은 electron microscopy image의 고배율.
Figure 7. bat pluripotent stem cell에서 endogenized viral elements의 Reactivation.
(A) nucleocapsid에 specific한 것으로 알려진 pan coronavirus antibody로 human 293FT 및 H9, mouse 3T3 및 R1, R. ferrumequinum BiPS 세포로부터 분리된 protein lysates의 Western blotting.
(B) pan coronavirus 검출 후 R. ferrumequinum(RFe) bat embryonic fibroblasts (BEF) 및 iPS 세포(상단) 및 M. myotis(MMy) bat uropatagium fibroblasts (BUF) 및 iPS 세포(하단)의 Immunofluorescence images.
(C) (B)에서와 같이 코로나 항원을 검출하고 DyeCycle Violet (DyeCV) nuclear counter stain (파란색) 한 후 R. ferrumequinum iPS 세포의 Representative STED microscopy image.
(D) RNA 바이러스의 double-stranded RNA(녹색) 특성을 검출한 후 R. ferrumequinum BiPS 세포의 Immunofluorescence image.
(E) (D)에서와 같이 double-stranded RNA(dsRNA)의 immunofluorescence staining 후 R. ferrumequinum iPS 세포의 Representative STED microscopy image.
(F) (D 및 E)에서와 같이 BiPS 세포의 immunofluorescence staining 후 ImageStream analysis.
(G) R. ferrumequinum iPS 세포에서 ImageStream에 의한 dsRNA foci의 정량화는 (F)에 표시.
Disscussion
박쥐는 날고, echolocation를 사용하며, 바이러스에 대해 curious affinity를 가지고 있기 때문에 포유류들 사이에서 특이한 생활 방식으로 진화해왔다. 한 가지 가능성은 박쥐가 포유류의 면역 반응의 바이러스 회피 메커니즘과 유사한 innate immunity의 변화를 진화시킴으로써 바이러스에 대한 내성을 진화시켰다는 것이다. 또 다른 가능성은 박쥐가 바이러스 복제와 지속성을 지원하기 위해 cellular program을 위한 메커니즘을 진화시켰다는 것이다. 우리의 결과는 두 가지 관점을 모두 뒷받침한다.
실제로, 우리의 결과는 endogenous 및 exogenous viral product의 잠재적으로 중요한 부대가 증식 및 성장 능력을 심각하게 손상시키지 않고 bat pluripotent stem cell에 존재하며 이것은 다른 pluripotent stem cell이 바이러스에 반응하는 방식을 넘어선다는 것을 보여준다. 바이러스는 일반적으로 replication cycle을 특정 cell type에 조정한다. 따라서 pluripotent stem cell state가 종종 바이러스의 전문화된 요구 사항과 일치할 것으로 기대하지 않을 것이다. 그럼에도 불구하고, 우리의 데이터는 박쥐에서 pluripotent state가 매우 다양한 바이러스 비상사태에 대한 ” umbrella” 숙주 역할을 한다고 제안한다. 우리는 우리의 문화 모델이 바이러스 감염의 내성을 위해 필요한 균형을 신중하게 해부하는 데 도움이 될 수 있다고 제안한다. 우리의 bat stem cell system은 또한 바이러스 저장소로서의 박쥐의 잠재적인 역할과 박쥐와 바이러스 사이의 관계에 대한 통찰력을 제공할 것이다. 폐나 내장 상피와 같은 면역 세포와 조직에 대한 체외 분화는 새로운 바이러스를 밝혀주고, 박쥐를 새로운 모델 연구 시스템으로 개발하며, 박쥐가 바이러스 감염을 어떻게 견디는지에 대한 새로운 통찰력을 제공하며, 우리가 미래의 유행병에 더 잘 대비할 수 있게 해줄 것이다.
지리적으로 관련된 지역에서 급성 acute exogenous bat viruses, tissue infection, persistent viruses 및 endogenized viruses의 Careful cataloging은 다양한 retroviral 및 non-retroviral sequence의 구성원을 드러내어 숙주와 새로 출현하는 바이러스에 잠재적으로 영향을 미칠 수 있다. 그것은 또한 면역 조절 전략, 다른 pathogens에 대한 symbiotic protection, 박쥐가 바이러스를 배치하기 위해 사용하는 biological warfare, mammalian adaptive piRNA 또는 CRISPR-like systems, 그리고 진화 과정의 증강을 포함한 바이러스 지속성에 대한 이유를 밝힐 것이다. 비록 우리가 특별히 연구하는 사건들이 있다 pluripotent stem cell은 특정 성인 세포에서 발생하는 것들에 직접적인 영향을 미치지 않는다. 우리는 pluripotent stem cell이 native immunity와 바이러스 연구에서 중요한 cell system이라고 제안한다. 그들은 체세포와 고도로 보존된 면역학적으로 관련된 공통 유전 프로그램을 공유한다. embryo와 관련 trophoblastic tissue의 pluripotent stem cell는 maternal tissue에 대한 면역학적 장벽을 확립해야 하며 박쥐에서도 언급된 것처럼 바이러스 감염의 대상이 된다. 게다가, 일부 기본 세포로서 생물학적 특성은 줄기세포들 사이에서 공유될 수 있다. 게다가, 일부 근본적인 세포 생물학적 특성이 줄기세포들 사이에 공유될 수 있기 때문에, 그 발견은 또한 예를 들어 rubella virus가 conceptus를 파괴하거나 심각한 congenital defect를 일으킬 수 있는 hematopoietic stem cell, neural stem cells, 그리고 early human embryo와 같은 감염의 위험이 있는 다른 stem cell들로 확장될 수 있다. 또한, pathogen pattern sensing 및 염증 반응을 포함한 대부분의 기본적인 native immunity systems은 그들의 가장 오래된 조상에 주로 존재하고 species 과 세포 유형 사이에 광범위하게 공유되는 기본적인 도구이다. 마지막으로, 박쥐 세포에 존재하는 viral RNA product는 또한 박쥐의 바이러스 진화의 동인이 될 수 있는 exogenous homologous viruses에 감염되었을 때 RNA 재조합의 잠재적인 원천을 나타낼 수 있다.
우리의 bat stem cell system은 바이러스와 숙주가 이전에 생각했던 것보다 더 얽히고 바이러스가 숙주 생물학의 완전히 유능한 에이전트이자 편집자라는 감질나는 가설을 분석하기 위해 매우 필요한 실험적 기질을 제공할 수도 있다. 그러므로 바이러스는 특히 living and chemical worlds 사이에서 전이할 수 있는 극단적인 유전적 적응성과 능력을 고려할 때 evolutionary instruction의 풍부한 원천임에 틀림없다. 바이러스 진화 과정이 박쥐 세포 라인에서 펼쳐지도록 하고 transcriptome 전사체에 대한 변화를 매핑하는 것은 host-virus editing interaction을 이해하는 데 중요한 단계가 될 것이다.
우리 연구의 결과는 bat stem cell이 바이러스 유전자 서열과 유사한 매우 다양한 서열을 포함한다는 proof-of-concept evidence를 제공한다. 게다가, 우리의 연구 결과는 retroviruses와 retroviruses 이외의 endogenous viruses의 일부가 지금까지 연구된 다른 동물이나 인간으로부터 유래한 tumor or stem cell line에서 일반적으로 볼 수 없는 규모로 생산되고 활성화된다는 것을 나타낸다. 우리는 pluripotency 의 transcriptionally permissive가 박쥐 생리학과 바이러스를 숙주로 하는 능력에서 필수적인 역할을 할 가능성이 있는 박쥐 바이러스와 파생 시퀀스를 발견하기 위해 이용될 수 있다고 결론짓는다.
박쥐는 질병에 대한 내성을 더 잘 이해하기 위해 필수적으로 필요한 모델 유기체이지만, 동물과 세포 모델에 대한 제한된 접근은 그들의 연구를 방해했다. 일부 종의 Bat breeding colonies는 확립하는 것은 악명이 자자하다; 대부분의 박쥐 종들은 전 세계적으로 보호되고 있고, primary bat cell line은 일반적으로 제한된 in vitro lifespan을 가지고 있다. 그러므로 pluripotent stem cell은 박쥐 연구에 필수적인 연구 도구를 제공한다. 일단 확립되면, pluripotent stem cell은 배양에서 무한히 분열되고 유전자 편집과 분자 연구에 매우 적응할 수 있다. 가장 중요한 것은 pluripotent stem cell은 신체의 어떤 종류의 세포로 분화할 수 있는 능력을 보유하고 있으며 종종 정교한 조직 배양 모델 그리고 더 최근에는 바이러스 백신을 위한 발판으로 사용된다. Bat stem cell에 대한 미래의 연구는 박쥐의 놀라운 비행 적응, echolocation, 극단적인 수명, 특이한 면역력을 포함하여 박쥐 생물학을 이해하는 모든 측면에 직접적인 영향을 미칠 것이다. 박쥐 게놈이 그러한 적응을 연구하는 자연스러운 출발점이고 Bat1K consortium에 의해 생성되고 있지만, 우리의 pluripotent stem cell system은 특정 박쥐 조직 연구를 가능하게 할 것이고, organoids는 우리가 더 복잡한 관계, 유전자 편집, 그리고 특정 진화 가설을 테스트할 수 있게 해줄 것이다. Bat stem cell line와 differentiated progeny는 감질나는 생리학적 질문을 해결하고, 검증에 필요한 도구를 제공하며, 박쥐에서 발견되는 희귀 적응의 게놈 기반을 활용하는 데 도움이 될 것이다.