성상세포-뉴런 하위 프로테옴과 강박 장애 메커니즘
Abstract
성상세포와 뉴런은 뇌에서 광범위하게 상호 작용합니다. 성상세포 및 뉴런 프로테옴을 식별하는 것은 생리 및 질병에 대한 각각의 기여를 지시하는 단백질 네트워크를 밝히는 데 필수적입니다.
이 연구에서는 생체 내에서 선조체 성상세포와 뉴런의 프로테옴을 연구하기 위해 세포별 및 하위 구획별 근접 단백질 바이오티닐화를 사용했습니다. 우리는 성상세포와 뉴런에 대한 세포질과 원형질막 구획을 평가하여 이들 세포가 신호 전달 장치의 단백질 수준에서 어떻게 다른지 발견했습니다. 우리는 또한 그들의 서브프로테옴과 필수 성상세포 신호 및 항상성 기능의 분자 기반을 밝히기 위해 말단과 미세 프로세스를 포함하여 성상세포의 세포 내 구획을 평가했습니다. 특히, 강박 장애 (OCD) 및 반복적 행동과 관련된 SAPAP3 (Dlgap3에 의해 암호화됨)은 선조체 성상세포에서 높은 수준으로 검출되었으며 액틴 세포골격 조직을 조절하는 특정 성상세포 하위 구획 내에서 농축되었습니다. 또한, SAPAP3가 결여된 OCD의 마우스 모델에서 행동 분석 및 분자 평가와 결합된 유전자 구조 실험은 반복적이고 불안과 관련된 OCD 유사 표현형에 대한 성상세포 및 신경 SAPAP3의 뚜렷한 기여를 밝혔습니다.
우리의 데이터는 성상세포와 뉴런이 단백질 수준과 주요 신호 전달 경로에서 어떻게 다른지 정의합니다. 또한, 그들은 성상세포 하위 단백질이 생리적 하위 구획 사이에서 어떻게 다른지, 그리고 성상세포와 신경 SAPAP3 메커니즘이 마우스의 OCD 표현형에 어떻게 기여하는지를 밝힙니다. 우리의 데이터는 성상세포와 뉴런을 모두 대상으로 하는 치료 전략이 OCD 및 잠재적으로 다른 뇌 장애를 탐색하는 데 유용할 수 있음을 나타냅니다.
Figure
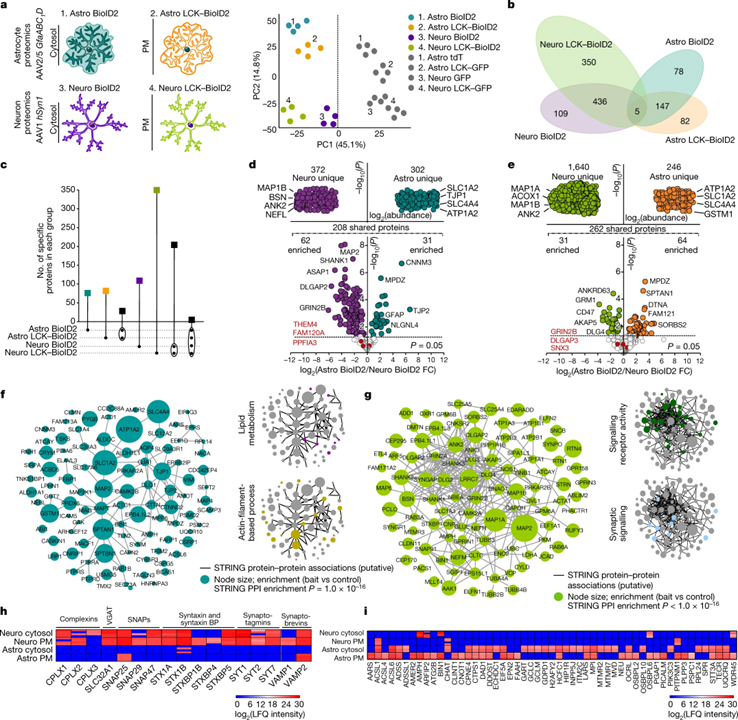
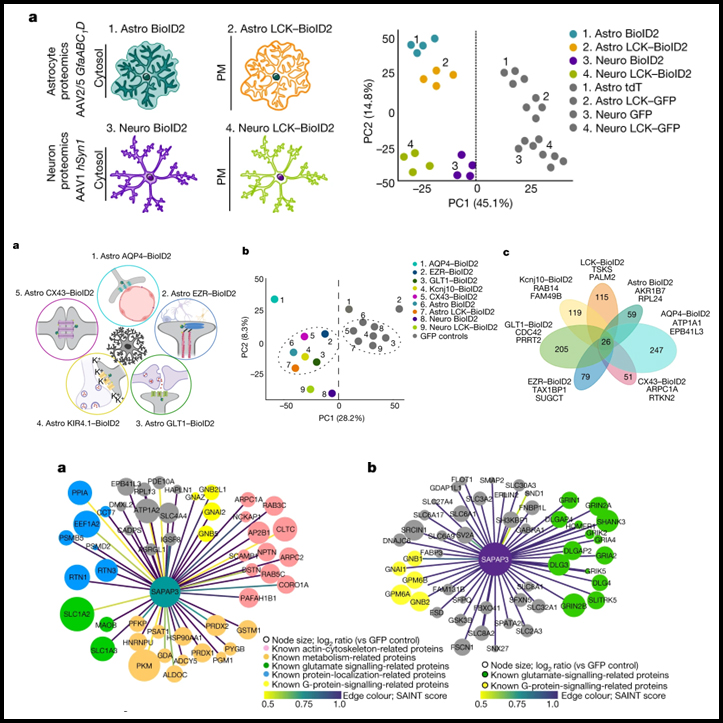
[Figure 1] 선조체 성상세포와 뉴런 프로테옴
(A) 왼쪽, 성상세포와 뉴런의 세포질과 PM에서 유전적으로 표적화된 BioID2를 나타내는 모식도. 오른쪽, 질량 분석법으로 검출된 모든 단백질의 PCA 플롯.
(B) 성상세포와 뉴런의 각 BioID2 구조 실험에서 검출된 단백질의 수를 나타내는 클러스터그램.
(C) BioID2 식별 단백질의 UpSet 플롯.
(D) 세포질 Astro BioID2 및 Neuro BioID2에 의해 검출된 단백질의 LFQ 비교. 상단, 서로 비교할 때 Neuro BioID2 또는 Astro BioID2에 특이적인 단백질. 하단, 세포질 Astro BioID2와 Neuro BioID2 모두에서 공유되는 단백질 비교.
(E) PM Astro BioID2 및 Neuro BioID2를 제외하고 d와 동일합니다.
(F) 왼쪽, Astro BioID2와 Astro LCK–BioID2로 확인된 상위 100개 단백질의 STRING 분석 맵. 오른쪽, 생물학적 과정에 대한 범주를 보이는 클러스터그램.
(G) f와 같은 Neuro BioID2 및 Neuro LCK–BioID2의 경우.
(H) 각각의 BioID2 구조물에 의해 확인된 Ca2+-의존성 소포 방출 단백질의 발현 수준.
(I) 각 BioID2 구조물에서 확인된 지질 대사와 관련된 단백질의 발현 수준.
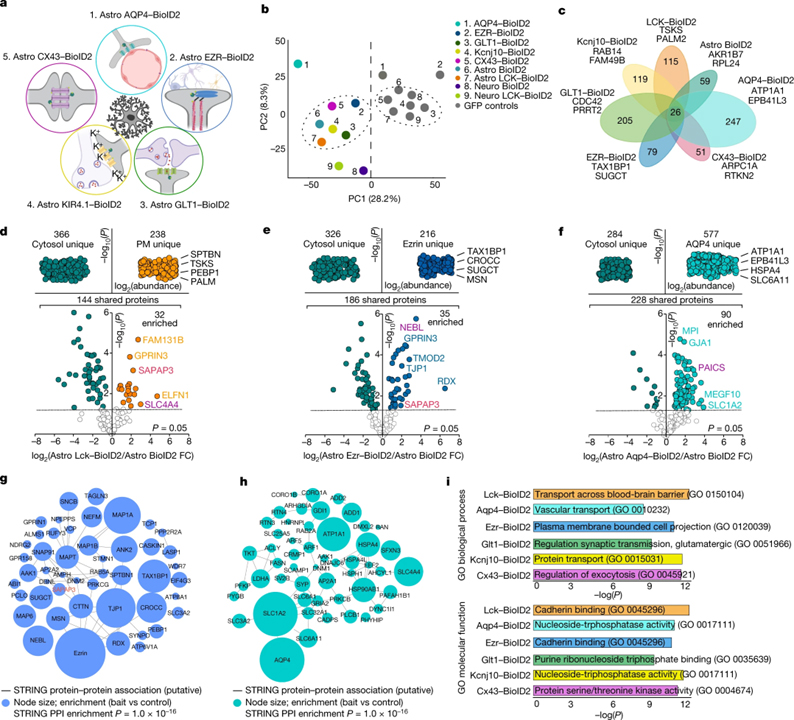
[Figure 2] 선조체 성상세포의 하위 구획별 프로테옴
(A) BioID2로 유전적으로 표적화된 5개의 성상세포 하위 구획을 보여주는 모식도.
(B) 각 BioID2 구조에서 식별된 모든 단백질의 평균 PCA 플롯.
(C) 각 하위 구획별 BioID2 실험에서 검출된 고유한 단백질 수를 나타내는 클러스터그램.
(D) 세포질 Astro BioID2와 PM Astro LCK–BioID2에서 검출된 단백질의 비표지 기반 정량 비교.
(E, F) 세포질 Astro BioID2와 Astro EZR–BioID2 (e) 및 세포질 Astro BioID2와 Astro AQP4–BioID2 (f)를 제외하고 d와 동일.
(G) Astro EZR–BioID2를 사용하여 성상세포 미세 프로세스에서 확인된 상위 50개 바이오티닐화 단백질의 STRING 분석 맵.
(H) g와 같지만 Astro AQP4-BioID2로 성상세포 말단에서 확인된 단백질.
(I) 성상세포 하위 구획에서 발견되는 독특하고 풍부한 단백질에 대한 가장 중요한 Enrich 유전자 온톨로지 (GO) 용어. 상단, 생물학적 과정에 대한 GO 용어. 하단, 분자 기능에 대한 GO 용어.
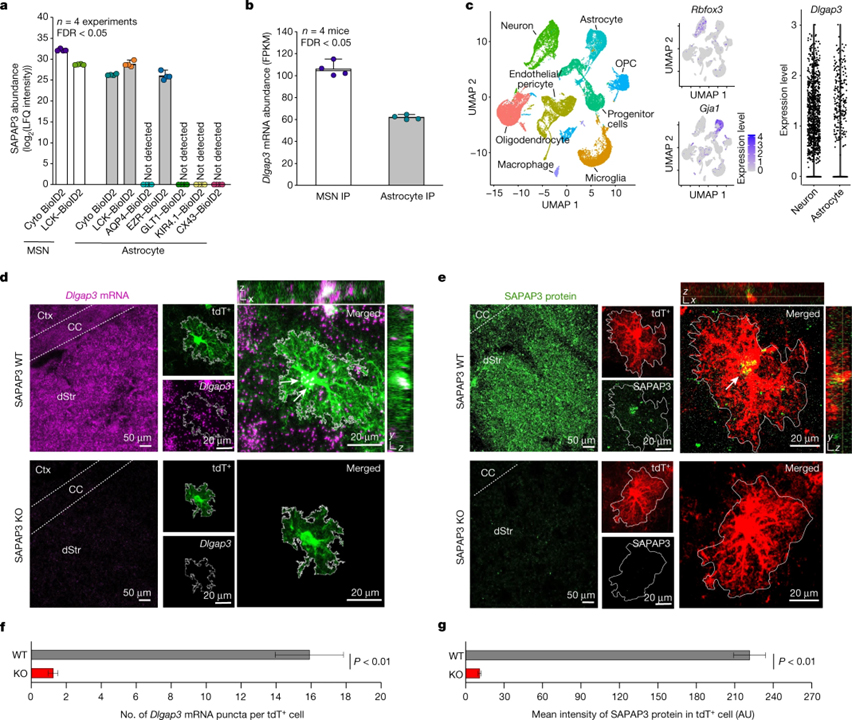
[Figure 3] 선조체 성상세포에서 SAPAP3 발현
(A) 뉴런과 성상세포 하위 구획에 걸친 SAPAP3 단백질 풍부도.
(B) 뉴런 또는 성상세포 RiboTag 면역침전 (IP)에서 백만 당 엑손의 킬로베이스당 조각, 매핑된 조각 (FPKM)에서 측정된 Dlgap3 mRNA 존재비.
(C) 왼쪽, 선조체 세포의 UMAP (uniform manifold approximation and projection) 플롯. 중간, 뉴런에서 Rbfox3의 발현 및 성상세포에서 Gja1. 오른쪽, 뉴런과 성상세포에서 세포당 Dlgap3의 상대적인 발현 수준을 나타내는 바이올린 플롯.
(D) Dlgap3 mRNA에 대한 RNAscope in situ 혼성화 및 tdTomato+(tdT+) 성상세포에 대한 IHC에 의해 표지된 WT 또는 SAPAP3 KO 마우스의 등쪽 선조체 (dStr)의 대표 이미지.
(E) SAPAP3 단백질에 대해 IHC로 표지된 WT 또는 SAPAP3 KO 마우스의 등쪽 선조체의 대표 이미지.
(F) WT 또는 SAPAP3 KO 마우스에서 tdTomato+ 성상세포 내의 Dlgap3 mRNA 반점의 수.
(G) WT 또는 SAPAP3 KO 마우스에서 tdTomato+ 성상세포 내 SAPAP3 단백질의 임의 단위 (AU) 강도.
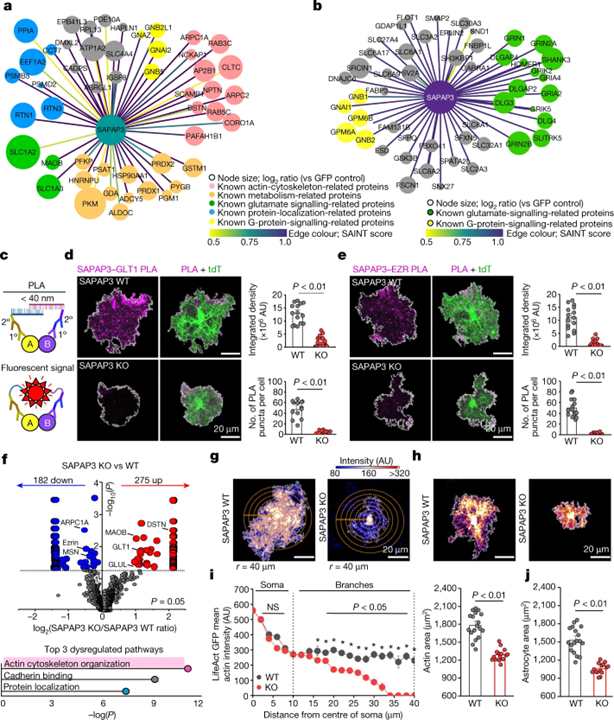
[Figure 4] SAPAP3의 분자 상호 작용 및 세포 메커니즘
(A) 49개의 별개의 단백질을 식별하는 SAPAP3 상호작용 성상세포 단백질의 지도.
(B) SAPAP3 상호작용 신경 단백질의 경우와 마찬가지로 상위 50개의 개별 단백질을 보이는 지도.
(C) PLA의 개략도.
(D) 왼쪽, tdTomato+ 성상세포 (WT 및 SAPAP3 KO)에서 SAPAP3와 GLT1에 대한 PLA 반점의 이미지.
(E) d와 같지만 SAPAP3와 ezrin 단백질 (WT 및 SAPAP3 KO).
(F) Astro LCK-BiolD2 프로테오믹스의 SAPAP3 KO 마우스에서 상이하게 표시된 성상세포 PM 단백질.
(G) WT 및 SAPAP3 KO 성상세포에서 LifeAct GFP를 보여주는 이미지.
(H) WT 및 SAPAP3 KO tdTomato+ 성상세포를 보여주는 이미지.
(I) 왼쪽, LifeAct GFP는 성상세포 체세포로부터의 거리 함수로서 액틴 강도. 오른쪽, 성상세포 액틴 영역.
(J) 성상세포 영역.
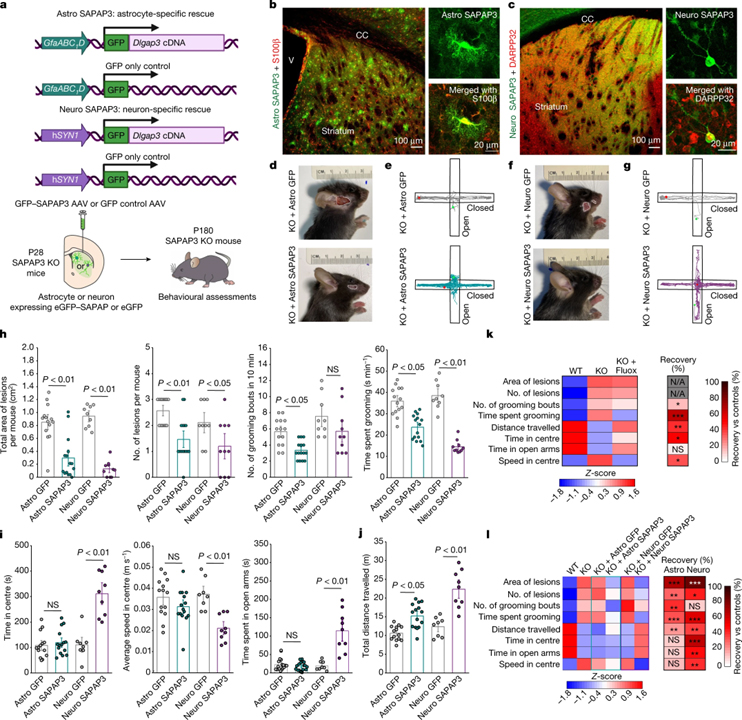
[Figure 5] 생쥐의 OCD 표현형에 대한 성상세포와 뉴런의 기여도
(A) SAPAP3의 세포 특이적 선조 구조의 개략도.
(B) Astro SAPAP3가 주입된 선조체.
(C) Neuro SAPAP3를 발현하는 Neuro SAPAP3 및 DARPP32+ 뉴런을 제외하고 b와 동일.
(D) Astro GFP 또는 Astro SAPAP3를 주입한 SAPAP3 KO 생쥐의 병변 이미지.
(E) Astro GFP 또는 Astro SAPAP3을 주사한 SAPAP3 KO 마우스에 대한 고가 플러스 미로 흔적.
(F, G) d 및 e와 동일하지만 Neuro GFP 또는 Neuro SAPAP3를 주입한 마우스의 경우.
(H) 세포 특이적 GFP 또는 SAPAP3로 처리된 SAPAP3 KO 마우스의 그루밍 행동.
(I) 세포 특정 GFP 또는 SAPAP3로 처리된 SAPAP3 KO 마우스의 불안 유사 행동.
(J) 세포 특이적 GFP 또는 세포 특이적 SAPAP3로 처리된 SAPAP3 KO 마우스에서의 운동 활성.
(K) WT 마우스, SAPAP3 KO 마우스 및 SAPAP3 KO 마우스에서 10mg/kg fluoxetine으로 처리한 행동 Z-점수의 히트맵.
(L) 세포 특이적 GFP 또는 SAPAP3로 처리된 WT 및 SAPAP3 KO 마우스 또는 SAPAP3 KO 마우스의 행동 Z-점수의 히트맵.
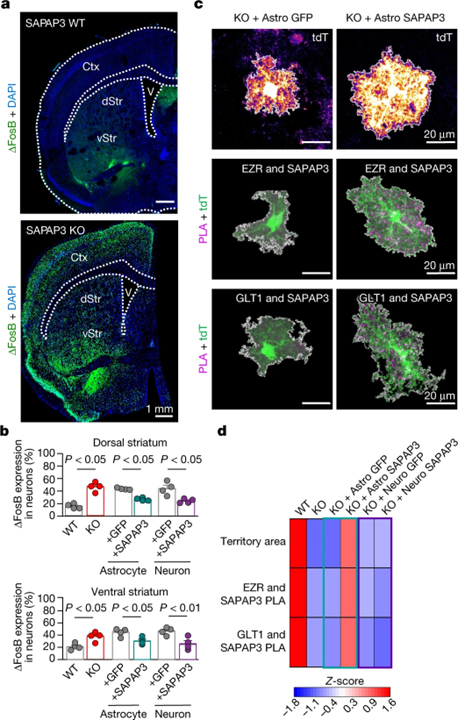
[Figure 6] 뉴런 ΔFosB 수준 및 SAPAP3 상호 작용에 대한 SAPAP3 손실 및 구조의 효과
(A) WT 및 SAPAP3 KO 마우스에서 선조체를 포함하는 관상 단면의 이미지.
(B) 등쪽 및 복부 선조체 모두에서 ΔFosB 발현을 갖는 NeuN+ 뉴런의 백분율.
(C) Astro GFP 또는 Astro SAPAP3를 주입한 SAPAP3 KO 마우스의 tdTomato+ 선조체 성상세포의 이미지.
(D) WT 및 SAPAP3 KO 마우스, Astro GFP가 주입된 SAPAP3 KO 마우스 또는 Neuro GFP 또는 Neuro SAPAP3가 주입된 Astro SAPAP3 및 SAPAP3 KO 마우스의 성상세포에서 측정된 매개변수의 Z-점수를 나타내는 히트맵.
Concluding comments
뇌 장애에 대한 성상세포와 뉴런의 상대적인 기여는 오랫동안 논의되어 왔으며 최근에는 RNA-seq 및 질량 분석법으로 평가되었습니다. 이러한 통찰력은 뇌의 다세포 상호작용을 이해해야 할 필요성과 함께 뉴런과 성상세포를 위한 맞춤형 도구를 사용하여 세포별 및 하위 구획별 방식으로 생체 내 프로테옴을 결정하는 자극을 제공했습니다. 세포질과 원형질막 구획에 대한 우리의 프로테오믹스 데이터는 성상세포와 뉴런에 의한 세포 유형별 신호 전달의 분자 기반을 정의하는 공유되고 별개의 단백질 및 신호 전달 경로를 밝혔습니다. 또한, 성상세포 하위 프로테오믹스는 형태학적으로 복잡한 성상세포에 의해 제공되는 분포된 생리학적 기능에 대한 분자 기반을 정의했습니다. 많은 단백질이 성상세포 하위 프로테오믹스에서 우선적으로 농축된다는 발견은 변경된 성상세포 형태 및 신호 전달을 수반하는 신경변성, 부상, 뇌졸중, 외상 및 중독 동안 병태생리학을 이해하는 데 중요한 의미가 있습니다. 전반적으로, 우리의 데이터는 유전자와 단백질 발현 사이의 관계가 성상세포 또는 그 하위 구획에 대해 간단하지 않다는 것을 보여주었습니다. 이와 같이 하위 구획 프로테옴은 이전에 알려지지 않은 분자와 경로의 풍부함을 나타내며 생체 내에서 성상세포와 뉴런을 종합적으로 탐색하기 위한 단백질 및 유전자 발현 데이터에 대한 요구를 충족합니다.
우리는 데이터에 의해 밝혀진 OCD 표현형과 관련된 성상세포 및 신경 메커니즘에 관한 새로운 발견을 탐구했습니다. OCD가 불완전하게 이해되고 제대로 치료되지 않기 때문에 이것은 흥미롭습니다. 강박증은 강박적 사고, 반복적인 행동으로 나타나는 강박, 불안을 특징으로 합니다. OCD는 인구의 약 2-3%에 영향을 미치는 만성 장애 정신 질환입니다. 일반적으로 신경 질환으로 간주되는 강박 장애는 선조체 회로 기능 장애를 포함하지만 장애의 분자 및 세포 기반은 명확하지 않습니다. 그러나 다양한 세포 유형이 OCD 표현형에 기여하는 것으로 나타나고 있습니다. 우울증과 변성에 대한 최근 연구를 바탕으로 우리의 실험은 성상세포와 뉴런 SAPAP3 메커니즘이 생쥐의 OCD 표현형과 관련이 있음을 보여주었습니다. 우리의 프로테오믹스 실험은 성상세포와 뉴런에 의해 공유되고 인간 OCD에 관여하는 단백질인 SAPAP3가 어떻게 성상세포 내에서 액틴 세포 골격에 영향을 미치는 별개의 성상세포와 뉴런 분자 상호 작용을 통해 OCD 관련 행동 표현형에 영향을 미치는지 보여주었습니다. 이것은 다세포 분자 기능 장애를 포함하는 더 큰 세트의 뇌 질환과 관련이 있지만 병인에 대해서는 추가적으로 이해가 필요하고 임상적으로 이용되어야 합니다. 성상세포와 뉴런 모두를 대상으로 하는 치료 전략은 OCD를 비롯한 기타 뇌 장애 탐색에 유용할 수 있습니다.
