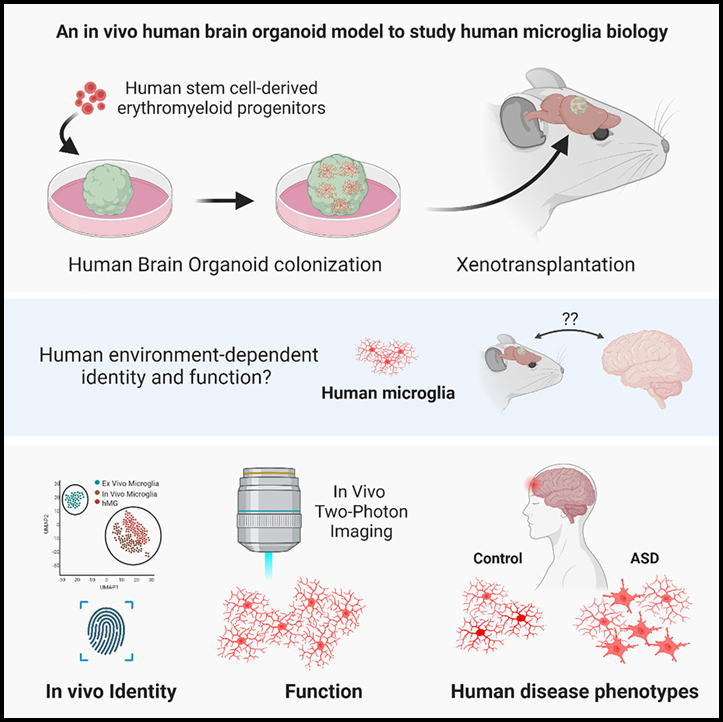
인간 microglia 표현형을 연구하기 위한 생체 내 신경면역 오가노이드 모델
Abstract
Microglia는 뇌 발달, 항상성 및 질병에 중요한 역할을 하는 특수 뇌 상주 대식세포입니다. 그러나 지금까지 인간의 뇌 환경과 microglia 사이의 상호작용을 모델링하는 능력은 심각하게 제한되었습니다. 이러한 한계를 극복하기 위해 우리는 생리학적으로 관련된 혈관화된 면역적격 인간 뇌 오가노이드 (iHBO) 모델 내에서 작동하는 기능적으로 성숙한 인간 microglia (hMG)를 연구할 수 있는 생체 내 이종이식 접근법을 개발했습니다.
우리의 데이터는 오가노이드 상주 hMG가 생체 내 대응물과 매우 유사한 인간 특유의 전사체 특징을 얻는다는 것을 보여줍니다. 생체 내 2광자 이미징은 hMG가 인간의 뇌 환경을 감시하고, 국소 손상에 반응하고, 전신 염증 신호에 반응하는 데 적극적으로 관여한다는 것을 보여줍니다. 마지막으로, 우리는 여기에서 개발된 이식된 iHBO가 건강과 질병에서 기능적 인간 microglia 표현형을 연구하고 대두증을 가진 환자별 자폐증 모델에서 뇌 환경 유발 면역 반응에 대한 실험적 증거를 제공할 수 있는 전례 없는 기회를 제공한다는 것을 입증합니다.
Figure
[Figure 1] 이식을 통한 생체 내 인간 뇌 오가노이드에서 인간 microglia의 성숙 및 장기 생존을 허용
(A) 실험 설계를 보여주는 개략도. EMP 함유 전뇌 오가노이드를 NOD/SCID 마우스의 후비장 피질에 이식하고 조직학적 특성화를 위해 이식 후 8주 (wpt)에 수확.
(B) 왼쪽, tdT+ 세포를 포함하는 인간 오가노이드 (GFP)로 이식된 코로나 뇌 섹션을 보여주는 대표적인 슬라이드 스캔 이미지. 오른쪽, 8wpt에서 IBA1을 공동 발현하는 tdT+ 세포를 보여주는 대표적인 공초점 이미지. 스케일 바, 20μm.
(C) 골수 마커 IBA1을 발현하는 tdT+ 세포의 백분율을 보여주는 막대 그래프.
(D) 생체 내 8wpt에서 골수성 특이적 전사 인자 PU.1 및 항상성 인간 특이적 microglia 마커 TMEM119를 발현하는 세포의 존재를 나타내는 대표적인 이미지. 스케일 바, 20μm.
(E) Imaris를 사용한 hMG 및 3D 재구성의 분기된 형태를 보여주는 대표적인 공초점 이미지. 스케일 바, 10μm.
(F) 생체 내 8wpt에서 관찰된 microglia 형태의 상대적 풍부함을 보여주는 원형 차트.
(G) 생체 내 8wpt에서 hMG에서 관찰된 공정 수의 정량화를 보여주는 박스플롯.
(H) 세포 복잡성의 척도로서 프로세스 교차점의 분포를 보여주는 Sholl 플롯.
(I) 생체 내 11wpt에서 독립적인 iPSC 라인에서 파생된 hMG의 특징적인 분지 형태를 보여주는 왼쪽의 대표 공초점 이미지. 스케일 바, 20μm. 오른쪽, 11wpt에서 3개의 독립적인 iPSC 라인에 대해 정량화된 분기된 형태를 특징으로 하는 tdT+ 세포의 백분율을 보여주는 막대 그래프.
(J) 생체 내 인간 뇌 오가노이드에서 11 wpt에서 인간 IBA1+ microglia (뇌 조직) 및 tdT+ hMG의 대표적인 공초점 이미지. 스케일 바, 50μm.
(K) 생체 내 인간 뇌 조직 및 인간 뇌 오가노이드의 hMG에서 microglia의 주요 프로세스 수 및 소마 크기의 분포를 보여주는 박스플롯.
[Figure 2] 생체 내 hMG 정체성의 전사체 특성화
(A) 실험 설계를 보여주는 개략도. EMP 함유 전뇌 오가노이드를 NOD/SCID 마우스의 후비장 피질에 이식하고 scRNAseq를 사용하여 tdT+-발현 hMG를 프로파일링하기 위해 11wpt에 수확.
(B) 품질 선택 기준을 통과한 프로파일링된 3개의 독립적인 iPSC 라인에서 파생된 1,027개의 tdT+ 셀의 UMAP 플롯.
(C) 주요 microglia 유전자 AIF1, CX3CR1, CSF1R 및 CST3의 생체 내 발현을 보여주는 특징 플롯.
(D) 생체 내에서 증식 마커 유전자 MKI67 및 RRM2의 발현을 나타내는 특징 플롯.
(E) 생체 내 hMG에서 항상성 microglia 유전자 P2RY12, TMEM119 및 SALL1의 발현을 나타내는 특징 플롯.
(F) 항상성 microglia 마커 P2RY12를 발현하는 hMG의 대표적인 공초점 이미지. 스케일 바, 20μm.
(G) tdT+ hMG에 의한 TMEM119의 발현을 보여주는 대표적인 공초점 이미지. 스케일 바, 20μm.
(H) 3개의 독립적인 iPSC 라인에 대해 11wpt에서 P2RY12 또는 TMEM119를 공동 발현하는 tdT+ 세포의 정량화를 보여주는 박스플롯.
[Figure 3] 생체 내에서 이식된 오가노이드의 항상성 microglia 상태의 발달 지원
(A) 실험 설계를 보여주는 개략도. GFP+ 전뇌 오가노이드는 38일에 이식되었고 이식 전 (38일)과 이식 후 (4 및 24wpt) 벌크 RNA-seq를 사용하여 프로파일링 진행.
(B) 인간 뇌 범위 데이터세트에 대한 이식 및 비이식 오가노이드 샘플의 전체 전사체의 Spearman 상관관계를 보여주는 히트맵.
(C) 신경 마커 유전자 SATB2 및 TBR1, 성상세포 마커 유전자 S100B 및 EAAT1, microglia 지지 인자 IL34 및 CSF1의 발현을 보여주는 히트맵.
(D) 11wpt에서 생체 내 hMG와 시험관 내 뇌 오가노이드에서 발달한 세포 상관 관계 간의 형태학적 비교. 스케일 바, 50μm.
(E) 시험관 내와 비교하여 생체 내 11wpt에서 분기된 형태를 특징으로 하는 tdT+ 세포의 백분율을 보여주는 박스플롯.
(F) 생체 내 및 시험관 내에서 11wpt에서 P2RY12를 공동 발현하는 tdT+ 세포의 대표적인 공초점 이미지. 스케일 바, 50μm.
(G) 생체 내 및 시험관 내에서 11wpt에서 P2RY12 또는 TMEM119를 공동 발현하는 tdT+ 세포의 백분율을 보여주는 박스플롯.
[Figure 4] hMG의 정의된 발달 궤적과 생체 내에서 인간-뇌-환경 의존 시그니처 획득
(A) 실험 설계를 보여주는 개략도. EMP 집락화 후, 신경-면역 오가노이드를 면역손상된 마우스에 이식하고, FACS를 사용하여 6, 11 및 24 wpt에서 수확한 다음, scRNAseq을 위해 처리.
(B) 품질 선택 기준을 통과한 프로파일링된 3개 시점에서 총 7마리 동물의 4,322개 tdT+ 세포의 UMAP 플롯.
(C) hMG 개발 중 초기에서 후기 시점으로의 전환을 반영하는 3개의 세포 궤적 간섭 히트맵.
(D) 마우스 microglia 발달 동안 변화하는 microglia 유전자와 의사-시간 유전자의 상당한 중첩을 보여주는 히트맵.
(E) 의사-시간 유전자는 인간 태아 microglia 발달을 정의하는 유전자와 상당한 중첩을 보이는 그래프.
(F) 임신 9주에서 18주 사이의 태아 hMG와 6~24wpt의 hMG의 통합 분석을 보여주는 UMAP 플롯.
(G) 면역 감지 microglia 상태로의 발달 전이를 정의하는 hMG 특이적 유전자 세트의 발현을 보여주는 특징 플롯.
(H) 6, 11 및 24wpt 사이에서 차등적으로 발현된 유전자를 보여주는 히트맵.
(I) 생체 내에서 hMG 발달 동안 상향 조절되는 주요 소교 세포 유전자 CX3CR1 및 P2RY12의 발현을 보여주는 특징 및 바이올린 플롯.
(J) Microglia 특이적 센섬 유전자의 발현 및 상대적 존재비를 보여주는 막대 그래프 및 점 그래프.
(K) 11~24wpt 사이의 인간-뇌-환경 의존적이고 성숙한 hMG 시그니처 획득을 보여주는 히트맵.
[Figure 5] hMG의 특징적인 면역 감지 특성과 생체 내 국소 및 전신 섭동에 대한 반응
(A) 생체 내에서 hMG의 운동성과 면역 감지 특성을 평가하기 위해 10.5~12wpt 사이에서 수행된 tdT+ hMG의 생체 내 이미징.
(B) 생체 내에서 10.5에서 12wpt 사이에서 수행된 tdT+ hMG의 생체 내 2광자 (2P) 이미징을 보여주는 대표 이미지. 스케일 바, 50μm.
(C) 실험 설계를 보여주는 개략도.
(D) 3가지 다른 시점에서 정량화된 개별 공정 운동성을 보여주는 막대 그래프. 각
(E) (D)에서 평가된 시점에서 hMG 밀도 (왼쪽) 및 이동 세포의 분율 (오른쪽)을 보여주는 박스플롯.
(F) 12 및 26 wpt에서 인간 오가노이드 이식편 내의 급성 레이저 병변에 따라 수행된 생체 내 이미징.
(G) 인간 오가노이드 이식편 (화살촉 및 빨간색 원) 내에서 수행된 급성 레이저 병변 (오른쪽) 후 (왼쪽) 및 10분 및 30분 전 생체 내 2P-이미징의 대표적인 이미지. 스케일 바, 50μm.
(H) 12wpt 및 26wpt에서 손상 부위까지 공정당 이동한 거리 측정값을 보여주는 박스플롯.
(I) 실험 설계를 보여주는 개략도. 5mg/kg의 농도로 그람 음성 세균 내독소 LPS를 복강 내 주사하여 신속한 선천적 면역 반응 유도 후 hMG 반응성을 평가하기 위해 주사 24시간 후 동물 수확.
(J) 대조군 및 LPS-챌린지된 hMG의 대표적인 공초점 이미지. 스케일 바, 50μm(왼쪽) 및 25μm.
(K) 전신 LPS 투여 24시간 후 hMG 집단 내에서 관찰된 상이한 형태학적 표현형의 백분율.
[Figure 6] 대두증이 있는 ASD에서 뇌 환경 유도 면역 반응을 나타내는 인간 환자별 모델의 생성
(A) 12wpt에서 ASD 및 제어 대상의 hMG를 보여주는 대표적인 공초점 이미지. 스케일 바, 50μm (왼쪽) 및 10μm (오른쪽).
(B) Somal filopodia 유무에 관계없이 microglia의 상대적 풍부함을 보여주는 파이 차트.
(C) 12wpt에서 소마 크기, 1차 공정 두께, 제어 및 ASD hMG의 필로포디아 밀도의 정량화를 보여주는 박스플롯.
(D) “센서” hMG를 포함하는 이종 신경면역 모델을 생성하기 위한 실험 설계를 설명하는 개략도.
(E) ASD에서 “센서” hMG의 대표적인 공초점 이미지 및 12wpt에서 생체 내 오가노이드 제어. 스케일 바, 25μm.
(F) ASD에서 “센서” hMG의 소마 크기 및 1차 프로세스 두께의 정량화 및 12wpt에서 생체 내 오가노이드 제어를 보여주는 박스플롯.
Disscussion
우리는 인간의 뇌와 유사한 환경 내에서 기능적 인간 microglia를 연구할 수 있는 오가노이드 이종이식 패러다임을 활용하는 새로운 접근 방식을 개발했습니다. 우리의 이종이식 패러다임은 원래 태아 또는 성인 조직을 설치류 뇌로 이식하기 위해 개발된 뇌내 이식 기술을 활용하여 숙주의 맥관 구조 시스템으로 이식된 뇌 오가노이드의 충분한 침투를 허용합니다. 생쥐와 쥐에서 유사한 오가노이드 이식 실험을 수행한 최근 연구에서는 체외 오가노이드에 비해 성숙의 세포 및 분자 상태가 향상되었음을 입증했습니다. 여기에서 개발된 이식된 iHBO 모델은 P2RY12, TMEM119 및 SALL1을 포함하여 오랜 기간 동안 생존하고 항상성, microglia 특정 마커를 표현한 hMG를 품고 있습니다. 임시 전사체 프로파일링은 hMG가 정의된 발달 궤적을 따르고, 면역 감지 특성을 획득하고, 생체 내 대응물과 매우 유사한 고유한 인간 특정 전사체 시그니처를 얻었다는 것을 밝혔습니다. 기능 분석에 따르면 통합된 hMG는 특징적인 감시 기능을 수행하고 인간 뇌와 유사한 환경에서 유도된 부상에 반응할 수 있으며 전신 염증 신호에 반응할 수 있습니다. 따라서 우리는 인간의 뇌와 유사한 생체 내 환경에서 작동하는 기능적 hMG를 얻을 수 있는 모델 시스템을 구축했습니다.
뇌 환경은 microglia 정체성을 유지하고 조율하는 데 중요한 역할을 합니다. 마우스와 인간을 대상으로 한 이전 실험에서 고립된 상태에서 성장한 microglia는 비생리학적, 부분적으로 활성화된 상태를 가정하는 것으로 나타났으며, 이는 유전자 발현 프로파일과 후생유전학적 환경의 극적인 변화에 의해 반영됩니다. 뇌 오가노이드는 뇌의 3D 구조의 일부 기능을 재현하고 신경외배엽 계통에서 파생된 여러 세포 유형을 포함합니다. 다양한 발달 계통의 기여로 인해 유도 접근법을 사용하여 microglia 함유 오가노이드를 생성하는 것은 매우 어려운 작업입니다. hPSC에서 microglia 유사 세포의 시험관 내 분화를 위한 프로토콜은 최근에야 사용할 수 있게 되었으며 PSC 유래 microglia를 뇌 오가노이드 및 3D 배양 시스템에 통합하는 새로운 전략을 개발할 가능성을 제공합니다. 단기 공동 배양 실험은 분화된 iPSC 유래 microglia 유사 세포를 오가노이드에 통합하는 것이 실현 가능한 것으로 나타났습니다. 또한 유도되지 않은 접근법을 통해 생성된 대뇌 오가노이드는 이러한 구조 내에서 중배엽 기여에서 나올 가능성이 있는 microglia 유사 세포를 자발적으로 본질적으로 개발할 수 있습니다. 그러나 이러한 체외 구조가 성숙과 장기 생존을 지원하는 정도와 통합된 세포가 궁극적으로 생체 내 대응물의 정체성과 완전히 유사한 상태를 획득하는지 여부는 아직 알려지지 않았습니다. Microglia 정체성을 복원하려는 최근의 시도는 hPSC 유래 microglia를 형질전환 면역손상 마우스 모델로 이종이식을 통해 달성되었습니다. hMG를 단독으로 연구할 수 있도록 발전했지만 인간 두뇌 환경과의 상호 작용을 충실하게 모델링할 수 있는 프로토콜은 여전히 부족합니다.
난황낭 유래 EMP는 인간의 경우 임신 4.5주에서 5.5주 사이에 뇌에 들어가는 것으로 추정됩니다. hPSC 유래 EMP를 생성하는 프로토콜을 채택하여 인간 전뇌 오가노이드에 microglia 진입을 모델링할 수 있었습니다. 흥미롭게도 우리는 그러한 면역적격 오가노이드 모델을 생성하는 데 있어 한 수준의 가변성이 공동 배양의 시기라는 것을 발견했습니다. 나이와 구조 구성이 EMP가 발달하는 오가노이드 구조에 들어가는 능력에 영향을 미칠 수 있기 때문입니다. 짧은 시간 동안 EMP는 인간 전뇌 특정 오가노이드 모델을 효율적으로 식민지화하고 원시 microglia 유사 세포로 분화하여 원시 분지 유사 형태를 보여주고 IBA1과 같은 골수 특이 마커를 발현합니다. 그러나 장기 분화는 통합된 세포의 점진적인 손실, 세포 활성화 및 활성화 및 스트레스 유발 유전자의 발현으로 나타난 바와 같이 시험관 내에서 심각하게 방해를 받는 것으로 나타났습니다. TMEM119, P2RY12와 같은 환경 특정 요인의 부재에 따라 이러한 결과는 hMG-뇌 상호 작용의 충실한 모델링을 허용하기 위해 생체 내에서 발견되는 상황과 더 유사한 지원 뇌 환경이 필요할 수 있음을 강조합니다.
이전 작업은 인간의 뇌 환경 요인이 microglia 관련 유전자 발현 프로그램을 유도하는 과정에 중요한 역할을 한다는 것을 보여주었습니다. hMG를 마우스 뇌에 이종 이식하면 생체 내 정체성에 특정한 일부 측면을 복원할 수 있지만, 특히 인간 질병의 맥락에서 인간 특정 기능의 완전한 획득과 인간 뇌 환경 의존적 표현형의 재현은 아직 이루어지지 않았습니다. 사실, 이전 연구에서 통합된 인간 세포가 마우스 CSF-1에 의해 적절하게 지원되지 않는다는 것이 밝혀졌기 때문에 마우스 뇌 내에서 hMG의 지속적인 생존을 위해서는 인간 CSF-1 또는 IL34의 형질전환 발현이 필요합니다. 이 발견에 따라 유전자 발현 패턴은 인간을 포함한 더 큰 포유동물의 microglia와 생쥐의 microglia 사이에 상당히 다릅니다. 핵심 microglia 프로그램은 여러 종에 걸쳐 보존되지만 종별 차이 중 일부는 인간 특유의 장애와 관련된 요인과 관련된 것으로 보입니다.
우리 시스템의 숙주 마우스가 CSF-1에 대해 인간화되지 않았기 때문에 혈관화 된 인간 오가노이드 이식편이 장기간에 걸쳐 그리고 외인성으로 공급된 인간 CSF-1이 없는 경우 hMG의 지속적인 생존을 지원하기에 충분했다는 점에 유의하는 것이 중요합니다. 또한, CSF-1R 리간드 IL34 및 CSF-1은 이식 후에 현저하게 상향조절 되었습니다. 이러한 결과는 그 경계 내에서 인간 오가노이드 이식편이 hMG의 지속적인 생존과 분화를 보장하기에 충분한 CSF-1/IL34를 제공한다는 것을 확인시켜줍니다. 더 중요한 것은 iHBO 상주 microglia가 hMG 정체성과 고유하게 관련된 유전자 발현 프로그램의 매우 특정한 유도를 보인 반면, 마우스 뇌 (xMGs)에 이식된 hMG는 또한 마우스 microglia 정체성과 관련된 유전자 발현 패턴을 유도했다는 것입니다. 이러한 관찰은 유전자 발현 패턴의 일부 차이가 마우스/인간 뇌 환경의 차이로 인한 것임을 시사합니다. 미래에는 여기에서 개발된 시스템을 통해 hMG 정체성을 조율하는 뇌 환경 측면을 풀 수 있을 것입니다.
추가적으로 발견되는 증거는 microglia가 인간 두뇌의 발달 또는 기능에 영향을 미치는 다양한 장애에 연루되어 있음을 시사합니다. 예를 들어, 여러 연구에서 ASD가 있는 어린이는 뇌의 여러 영역에서 진행 중인 신경염증 과정을 겪는다는 사실이 밝혀졌습니다. 이 발견에는 활성화된 microglia와 조절 장애가 있는 microglia 관련 유전자 발현 시그니처를 확인한 사후 뇌 및 양전자 방출 단층촬영의 증거가 포함됩니다. 또한 ASD가 있는 어린이의 뇌와 뇌척수액에서 불규칙한 전염증성 사이토카인 프로파일과 변경된 보체 인자 프로파일이 보고되었습니다. 사후 조직에서의 현상학적 관찰과는 별도로, 인간 두뇌 발달 동안 microglia의 역할과 기능은 주제별 신경세포-microglia 상호작용의 연구를 허용하는 적합한 모델 시스템의 부족으로 인해 거의 미지의 영역으로 남아 있습니다. 이식된 iHBO 모델이 제공하는 한 가지 장점은 인간과 같은 환경에서 전신 및 국소 섭동이 생체 내 개발의 몇 개월 동안 hMG 누화에 어떻게 영향을 미치는지 연구하는 능력입니다.
이 연구에서는 ASD에서 인간의 뇌 환경/microglia crosstalk을 조사하기 위해 환자별 신경 면역 모델의 생성을 보고합니다. 우리는 비정상적인 신경 발달 과정에 대한 만성 및 조기 출현 반응을 나타낼 수 있는 microglia 표현형의 환경 유발 세포 비 자율적 변화에 대한 첫 번째 실험적 증거를 제공합니다. 관찰된 형태학적 변화는 프라이밍되고 반응성이 더 높은 microglia 상태와 관련이 있으며 이전에 ASD 환자의 사후 조직에서 보고되었습니다. 중요하게도, 우리의 실험은 microglia 반응성의 이러한 변화가 microglia 자체가 아니라 환경에 의해 유도되었음을 밝혔습니다. ASD에 대해 보고된 성별에 따른 차이를 감안할 때, 인간 and/or 숙주 뇌 환경의 성별 차이가 이 표현형에 어떻게 기여하는지를 밝히기 위해서는 추가적인 연구가 필요합니다. 여기에서 개발된 새로운 플랫폼은 hMG와 인간 신경 환경의 기능적 상호 작용을 모델링할 수 있는 고유한 기회를 제공하여 개발 및 질병 동안 상황에 따라 달라지는 hMG 표현형의 역할을 밝히는 데 매우 적합한 기술을 제공합니다.