epigenetic barrier가 인간 신경 세포의 성숙 타이밍을 결정한다
Abstract
인간 뇌 발달의 속도는 다른 종들에 비해 현저히 느리다. 특히, 대뇌 피질 신경 세포의 성숙은 몇 달에서 수년에 걸쳐 성인 기능을 갖추게 되는데, 이러한 느린 발달 속도는 *인간 다능성 줄기세포(human pluripotent stem cells, hPSCs)로부터 유래된 신경 세포가 체외에서 분화하거나 마우스 뇌에 이식될 때에도 유지된다. 이는 신경 세포의 성숙 속도를 결정하는 세포 내 시계가 존재함을 암시하지만, 그 분자적 본질은 아직 명확히 밝혀지지 않았다. 본 연구에서는 인간 신경 세포의 성숙 타이밍을 설정하는 epigenetic 발달 프로그램을 확인했다. 먼저, hPSCs 기반 방법을 통해 대뇌 피질 신경 세포의 탄생을 동기화시켜 형태학적, 기능적, 분자적 성숙 단계를 규명했다. 우리는 특정 epigenetic 요소의 유지가 성숙 프로세스를 느리게 전개되도록 함을 관찰했다. 또한, 피질 신경 세포에서 이 요소들의 기능 일부가 상실될 경우 신경 세포의 조기 성숙이 가능함을 발견했다. 전구체 단계에서 EZH2, EHMT1 및 EHMT2 또는 DOT1L을 일시적으로 억제하면 새로 탄생한 신경 세포가이 분화할 때 성숙한 특성을 빠르게 획득하도록 유도한다. 이는 인간 신경 세포의 성숙 속도가 신경 발생 훨씬 전에 설정되며, 이러한 과정이 전구세포에서의 epigenetic barrier 설정을 통해 이루어진다는 것을 의미한다. 기계적으로, 이 epigenetic barrier는 transcriptomic 성숙 프로그램을 준비 상태에서 유지하며 점진적으로 방출되어 인간 대뇌 피질 신경 세포의 장기적인 타임라인을 보장한다.
* 인간 다능성 줄기세포(human pluripotent stem cells, hPSCs): 인간의 조직이나 장기를 재생하는 데 필수적인 세포 유형으로, 수정된 배아에서 유래한 배아줄기세포(embryonic stem cells, ESCs)와 성인 조직으로부터 얻은 세포를 유전적으로 재프로그래밍하여 만든 유도만능줄기세포(induced pluripotent stem cells, iPSCs) 등으로 나뉨.
Figures
hPSC-based model of neuronal maturation
– 신경 세포의 성숙 과정을 연구하기 위해 hPSC에 기반해 같은 시간에 분화하는 균질한 신경 세포 플랫폼을 개발함.
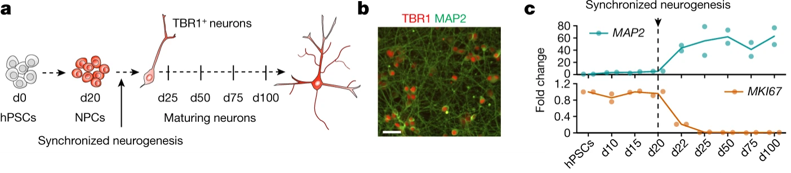
Fig. 1(A-C). 동기화된 hPSCs 유래 피질 신경세포의 형태학적·기능적 성숙
(A) 실험 체계. d20(20일차)에서 동기화된 신경 발생을 위해 hPSC 유래 피질 신경전구세포(Neuronal Precursor Cells, NPCs)를 유도하고, d25, d50, d75 및 d100에서 신경세포를 분석.
(B) TBR1에 염색된 신경세포 배양의 대표 이미지.
(C) 역전사 정량적 중합효소연쇄반응(quantitative PCR with reverse transcription, RT-qPCR)을 통한 분화 과정에서의 MKI67 및 MAP2의 발현.
[Fig 1A] 기존 연구의 경우 신경 세포가 분화되는 시간에 차이가 있고, 세포간 이질성이 발생함. 본 연구에서는 이를 극복하기 위해 hPSC에 기반해 같은 시간에 분화하는 균질한 NPCs를 생성하는 플랫폼을 개발해 연구를 진행.
[Fig 1B, C] 해당 플랫폼을 통해 만들어진 신경 세포가 균질한 특징 (TBR1+, 동기화된 neuronogenesis의 시기)을 가짐.
hPSC-derived neurons mature gradually
– hPSC 플랫폼을 통해 발달한 신경세포가 형태학 및 기능적으로 성숙하는 과정을 관찰.
– hPSCs 유래 신경 세포가 형태학적 (신경돌기의 길이 및 복잡성 등), 기능적 (다중 유발 행동 전위의 발생, Ca2+ 신호, 동기화된 신호 발생 비율 등) 측면에서 시간에 따라 정상적으로 성숙함을 확인.
– 각 단계별로 발현량이 증가하는 유전자 및 accessibility가 증가하는 chromatin region을 식별해 신경 세포 성숙 과정의 분자적 signature를 식별.
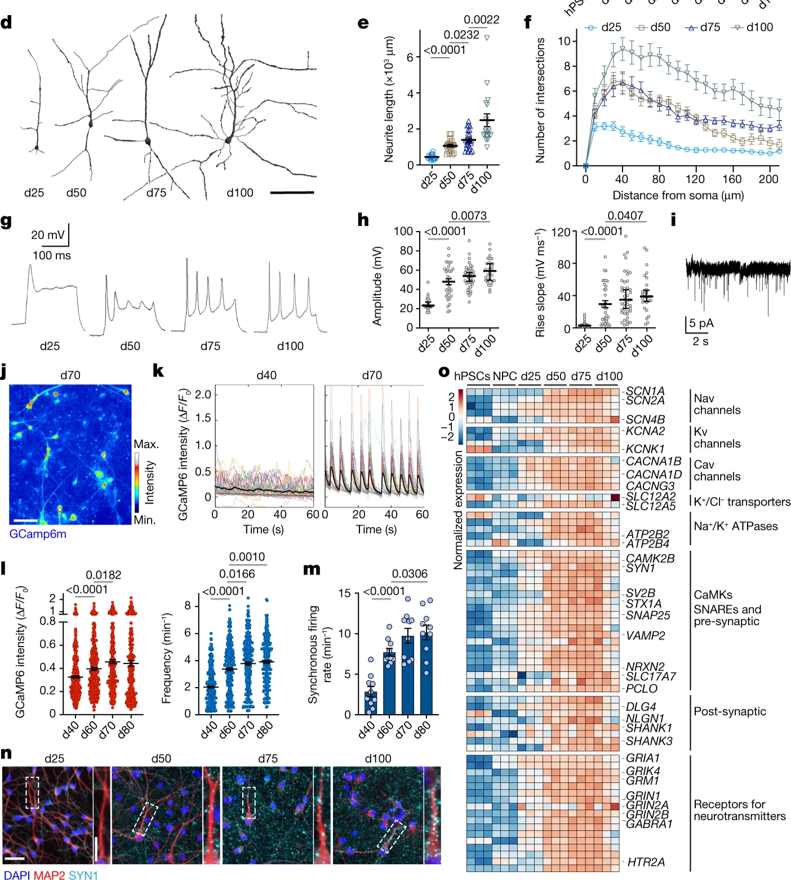
Fig. 1(D-O). 동기화된 hPSCs 유래 피질 신경세포의 형태학적·기능적 성숙
(D-F) 신경세포 형태의 (D) 대표적인 재구성 및 (E) 신경돌기 길이, (F)복잡성의 정량화.
(G) 유발된 행동 전위의 전기생리학적 기록의 대표적인 흔적(trace)
(H) 시간에 따른 행동 전위의 진폭 및 상승 기울기의 전기생리학적 측정 정량화.
(I) d75에서 *미니어처 흥분성 시냅스 후 전류(miniature excitatory postsynaptic currents, mEPSCs)의 대표적인 trace.
(J) d70에서 Ca2+ 이미징의 최대 강도 투영의 대표적인 예.
(K) d40과 d70 신경 세포에서 정규화된 **GCaMP6m 강도의 대표적인 trace.
(L) 자발적인 Ca2+ 스파이크의 진폭과 빈도의 정량화.
(M) 이미징 당 분당 동기화된 firing rate.
(N) 성숙 중인 신경 세포에서 SYNI와 MAP2 염색한 대표적인 이미지. 주 이미지에서 강조된 영역은 오른쪽에서 확대됨.
(O) RNA-seq에 의해 신경 기능에 중요한 역할로 선택된 transcripts들의 normalized expression 값의 heatmap.
* 미니어처 흥분성 시냅스 후 전류(miniature excitatory postsynaptic currents, mEPSCs): 신경세포에서 자발적으로 발생하는 작은 전기적 활동으로, 특히 신경전달물질이 후시냅스 세포의 수용체에 결합하여 발생하는 전류.
** GCaMP6m: 칼슘 센서 단백질의 한 종류로, 신경세포 내에서 칼슘 이온(Ca2+)의 변화를 감지하여 신호를 시각화하는 데 사용.
[Fig 1D-F] hPSCs 유래 신경세포가 시간에 따라 신경돌기 분절의 길이 및 복잡성이 증가하며 성장하는 것을 관찰.
[Fig 1G, H] hSPCs 유래 신경세포가 시간에 따라 성숙한 전기생리학적 특성을 가지는 것을 관찰. 예를 들어, Fig 1G에서 25일에 새로 태어난 신경 세포는 불완전하거나 낮은 진폭의 단일 유발 활동 전위를 가지나, 이후 진폭이 증가되고 반복적인 유발 활동 전위를 갖는 등으로 성숙.
[Fig 1I-L] hSPCs 유래 신경 세포의 기능적 성숙을 관찰. 흥분성 시냅스 기능이 발달하고, 신경 세포 활동의 중요한 지표인 Ca2+ 스파이크가 점차 증가함을 보여줌.
[Fig 1M] 여러 신경 세포가 동시에 행동 전위를 생성하고 전달하며 성공적으로 동기화됨을 보여줌.
[Fig 1N, O] 기능적 특성의 점진적인 발현이 신경 세포의 특정 지역(presynaptic puncta-like structure)에 SYN1이 집중되는 것과 관련됨.
[Fig 1O] RNA Seq으로 신경 흥분성 및 연결성과 관련된 유전자들이 시간에 따라 조정되어 발현되는 것으로 신경 세포의 기능적 발달을 확인함.
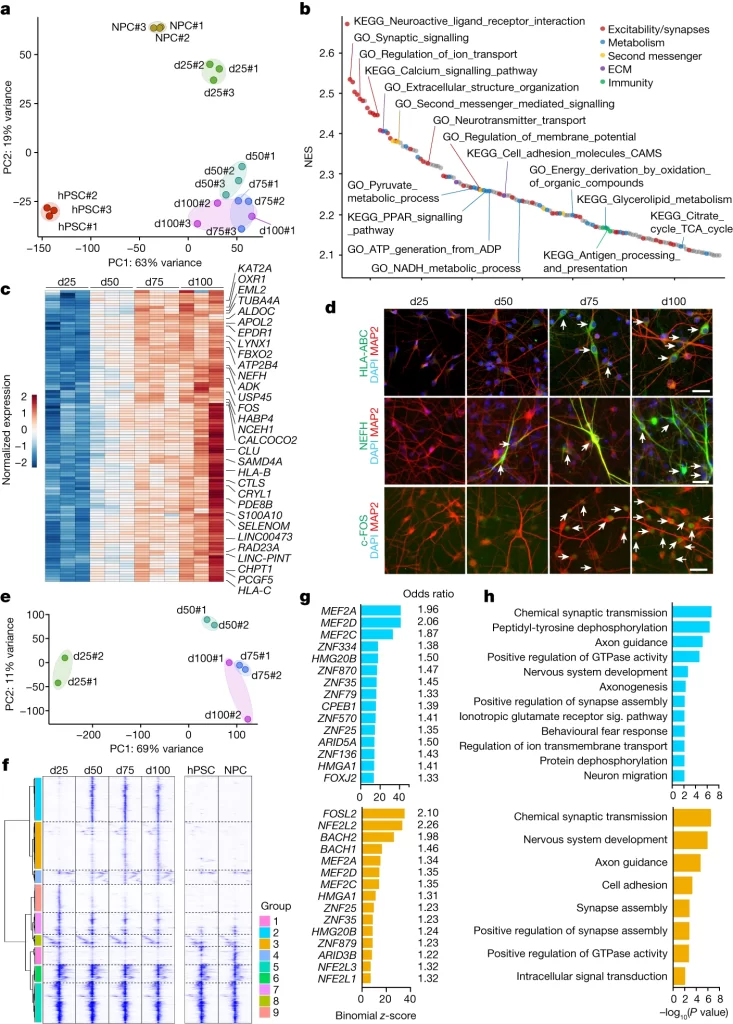
Fig. 2. 신경세포 성숙의 분자적 단계
(A) RNA-seq 데이터의 PCA 분석 결과. 상위 1000개의 차등 발현 transcripts의 발현량(variance-stabilized normalization을 거침)으로 분화 시간에 따른 샘플 분포를 보여줌.
(B) d50와 d25의 transcript expression을 비교해 GSEA 분석을 통해 성숙화된 신경 세포에서 더 농축된 상위 150개의 패스웨이를 보여주는 Waterfall plot.
(C) 강한 단조증가를 가진 상향 조절 transcripts (최대 log fold change가 어떤 비교에서도 1보다 크고 RPKM 발현값이 어떤 시점에서나 5보다 큰 경우)의 normalized temporal expression을 보여주는 heatmap.
(D) 지정된 성숙의 지표 마커로 염색된, 지정된 시간점에서의 신경 세포의 대표 이미지.
(E) ATAC-seq 데이터셋의 PCA 분석 결과. 성숙 단계에 따른 샘플의 분포를 보여줌.
(F) 신경 세포에서 차등적 chromatin accessibility를 가지는 ATAC-seq 피크를 Ward linkage를 사용해 집단적 계층적 클러스터링한 결과. 각 단계별로 특이적인 chromatin accessibility를 가진 9개의 피크 그룹을 식별.
(G) 시간이 지난 후 chromatin access가 가능해지는 ATAC-seq 그룹 2(상단)와 3(하단) 피크에서 초기하분포 검정에 따라 상위 15개의 농축된 전사 인자 결합 모티프를 확인.
(H) 시간이 지난 후 chromatin access가 가능해지는 ATAC-seq 그룹 2(상단)와 3(하단) 피크와 연관된 유전자에 대한 GO 용어 분석. 시냅스 관련 경로에 대한 농축을 보여줌.
[Fig 2A] gene
expression을 기반으로 발달 단계에 따른 변화가 25일에서 50일로 변할 때 가장 큰 것을 확인.
[Fig 2B-D] d25와 d50을 비교해 성숙한 신경 세포에서의 기능적 마커를 선별하고, 실제 신경세포를 이들 마커로 염색해 점진적 상향 조절을 확인.
[Fig 2E, F] 시간이 지남에 따라 차등적으로 변화하는 chromatin
region을 식별.
[Fig 2G, H] 시간이 지났을 때 chromatin access가 가능해지는 (d25에서 d100으로 갈수록 accessibility가 증가) motif가 어떤 유전자와 연관됐는지 확인하고, 해당 유전자들의 기능적 특징을 확인함.
Epigenetic switch of neuronal maturation
– 앞서 Figure 2에서는 시간의 흐름에 따라 발현량이 증가하는 transcript 및 accessibility가 증가하는 chromatin에 초점을 맞췄다면, 여기서는 발현이 감소하는 transcript와 이를 조절하는 chromatin regulator를 식별.
– 신경 세포 성숙과 음의 상관관계를 가지는 패스웨이에 chromatin structure 및 epigenetic 관련 패스웨이가 다수 포함.
– 신경 세포 성숙 과정에서 일관되게 하향 조절되는 유전자가 신경 세포 성숙을 지연시킬 것으로 가정하고 이들을 KO 시킨 결과 세포 성숙이 가속화됨을 확인.
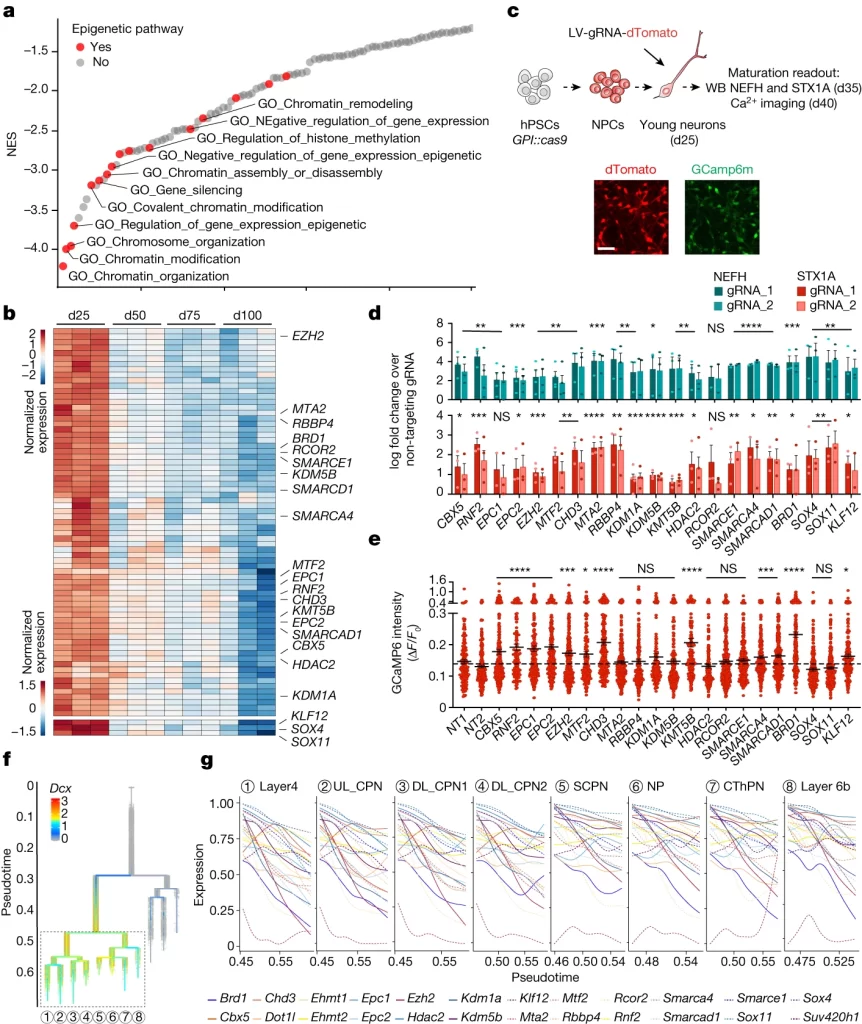
Fig. 3. epigenetic switch가 신경 세포의 성숙을 유도
(A) d25와 d50의 RNA-seq 샘플을 GSEA를 사용하여 비교했을 때 신경 세포 성숙과 음의 상관관계를 가지는 상위 100개 경로의 waterfall plot.
(B) 성숙 기간에 단조 하향 조절된 chromatin regulator의 normalized expression에 대한 heatmap. 상단은 epigenetic factor, 하단은 transcription factor.
(C) hPSC로부터 유래된 대뇌 신경 세포에서의 유전자 Knock Out을 위한 실험 개요. d25에서 Cas9을 발현하는 신경 세포는 유전자별 gRNA를 인코딩하는 렌티바이러스로 감염됨. 조기 성숙 유도는 d35에서 웨스턴 블롯(WB)과 d40에서 Ca2+ 이미징으로 평가.
(D) 신경 세포에서의 유전자 녹아웃에 따른 성숙 마커 NEFH 및 STX1A의 정규화된 웨스턴 블롯 발현(유전자 당 두 개의 gRNA).
(E) 유전자 KO 후 개별 신경 세포의 자발적 Ca2+ 스파이크의 진폭.
(F) 마우스 발달의 scRNA-seq 데이터에서 Dcx 발현을 보여주는 분기 계통 트리
(G) 마우스 대뇌피질에서 여러 신경 세포 아형에 걸쳐 hPSCs 유래 신경 세포에서 교란됐었던 인간 유전자(Fig.3 D)와 상동성이 있는 마우스 chromatin regulator 유전자의 시간적 발현 성숙 기간에 단조 하향 조절된 chromatin regulator의 normalized expression에 대한 heatmap. 상단은 epigenetic factor, 하단은 transcription factor.
[Fig 3A] 신경 세포의 지연된 성숙을 유도하는 요소를 식별하기 위해 성숙 과정에서 하향조절되는 패스웨이들을 관찰. chromatin structure 및 epigenetic 관련 패스웨이가 다수 포함됨.
[Fig 3B] epigenetic factor에 집중해 성숙 과정에서 일관되게 하향 조절되는 유전자 set를 식별.
[Fig 3C-E] Fig 3B에서 식별된 유전자들을 KO하며 신경 세포의 성숙을 지연시키는 요소를 식별하고자 함. 특정 유전자를 KO했을 때 신경 세포 성숙의 지표인 NEFH 및 STX1A 발현이 증가하는 것을 WB로, 기능적 성숙의 지표인 Ca2+ 스파이크 진폭이 상승하는지를 Ca2+ 이미징으로 확인.
[Fig 3F, G] 마우스 대뇌 피질에서도 인간 신경 세포의 성숙 과정에서 하향 조절되는 유전자가 유사하게 하향 조절되지만, 인간의 경우보다 더욱 빠르게 감소함. 이는 이러한 유전자들이 마우스와 인간 모두에서 세포 성숙을 지연시키는 유전자이며, 인간의 경우 이들 유전자가 더 느리게 감소해 인간 특유의 느린 신경 세포 성숙을 유발할 수 있음을 보여줌.
An epigenetic barrier in NPC sets maturation pace
– 신경 세포의 성숙을 조절하는 epigenetic factor가 분화 전인 NPC 단계에서 이미 발현하며, 이를 신경 세포 성숙을 방지하는 epigenetic barrier를 형성한다는 가설을 수립.
– Epigenetic inhibitor를 통해 이러한 barrier를 제거할 경우 신경 세포의 성숙을 가속화할 수 있었으며, 특히 EZH2를 inhibit할 경우 기능적 성숙이 가장 유의미하게 이뤄짐.
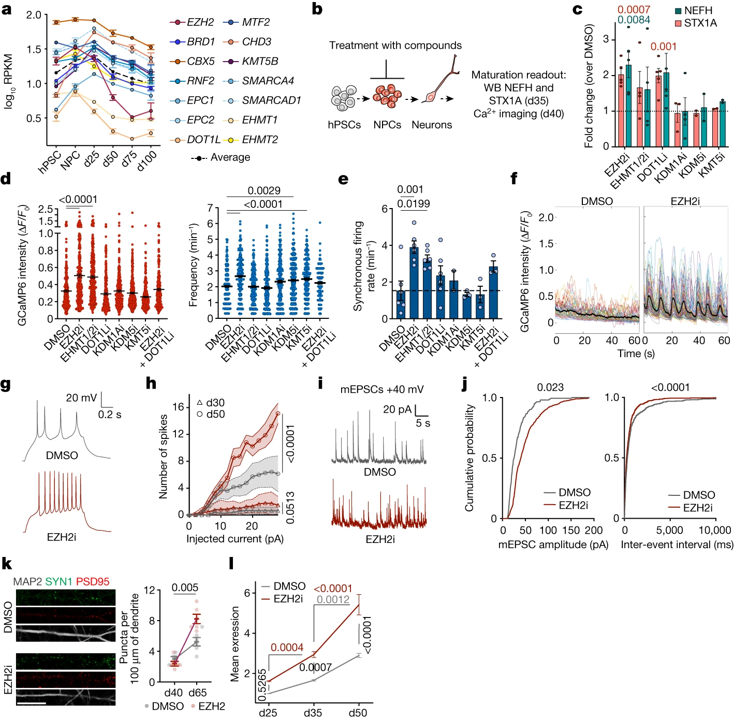
Fig. 4(A-L). NPCs에서 epigenetic factor의 가변적인 억제는 신경세포의 더 빠른 성숙을 유도함
(A) KO 연구에서 얻은 epigenetic marker들의 시간적 발현을 RNA-seq으로 분석.
(B) epigenetic inhibitor 처리에 따른 신경 세포 성숙을 관찰하는 실험 개요. NPCs를 d12-d20까지 일시적으로 epigenetic inhibitor로 처리한 뒤 신경 세포의 성숙 여부를 WB(d35)와 Ca2+ 이미징(d40)으로 평가.
(C) 웨스턴 블롯을 통한 NEFH와 STX1A의 normalized expression 분석 결과.
(D) 자발적인 Ca2+ 스파이크의 진폭과 빈도.
(E) 동기화된 firing rate.
(F) 정규화된 GCaMP6m 신호의 대표적인 trace.
(G, H) d50에서 측정, 주입된 전류당 유발된 행동 전위의 (G) 대표적인 trace, (H) 스파이크의 수.
(I, J) mEPSCs의 (I) 대표적인 trace, (J) 진폭 및 빈도
(K) 인접한 SYN1-PSD95 puncta의 대표적인 이미지와 정량화
(L) EZH2i 및 DMSO 처리된 NPC로부터 얻은 신경 세포에서의 단조 증가 transcripts의 RNA-seq normalized expression (d25 DMSO로 normalization)
[Fig 4A] 신경 세포의 성숙을 조절하는 대부분의 epigenetic factor는 분열 중인 NPCs에서 이미 발현 중이며, 이는 chromatin regulator들이 신경 세포로 발달하기 전 hPSC에서 NPC로 전환되는 단계에서 epigenetic barrier를 형성할 수 있음을 시사.
[Fig 4B] 위 가설의 검증을 위해 위의 epigenetic regulator들을 약물로 억제하는 실험을 설계.
[Fig 4C] 특정 epigenetic inhibitor(EZH2i, DOT1Li 등) 처리가 신경 세포의 성숙 마커의 발현을 증가시킬 수 있음을 확인.
[Fig 4D-F] epigenetic inhibitor 처리에 의해 신경 세포의 기능적 성숙을 나타내는 Ca2+ 스파이크의 진폭 및 빈도 지표, 동기화된 신호 발생 비율이 DMSO 처리군 대비 증가할 수 있음을 확인. 이중 EZH2i가 성숙 지표를 가장 유의하게 상승시킴.
[Fig 4G, H] epigenetic inhibitor인 EZH2i 처리에 의해 신경 세포의 기능인 유발 활동 전위의 수가 증가하는 것으로 대조군인 DMSO 처리군 대비 성숙된 기능을 획득함을 확인.
[Fig 4I, J] 역시 EZH2i 처리로 신경 세포의 기능 지표인 mEPSC가 더 높은 빈도로 발생하는 것으로 대조군인 DMSO 처리군 대비 성숙된 기능을 획득함을 확인.
[Fig 4K] EZH2 inhibitor로 NPC 단계에서 처리된 인간 배아 줄기 세포와 iPSCs 유래 신경 세포는 d65에서 전시냅스, 후시냅스 및 인접 시냅스에서 중요한 마커인 SYN1과 PSD95의 밀도가 증가하며, 이는 DMSO 처리군 대비 시냅스 구조가 더욱 발달한 것을 보여줌.
[Fig 4L] EZH2 inhibitor를 처리한 그룹은 35일에 신경 세포 발달 과정에서 지속적으로 증가하는 transcript의 평균 expression이 DMSO 그룹의 50일과 유사할 정도로 빠르게 성숙이 이뤄짐.
The epigenetic barrier in forebrain organoids
– 전뇌(forebrain) organoid의 신경 패턴이 형성된 후 epigenetic inhibitor를 처리했을 때 대조군 대비 유의미한 신경 발달의 가속화가 이뤄짐.
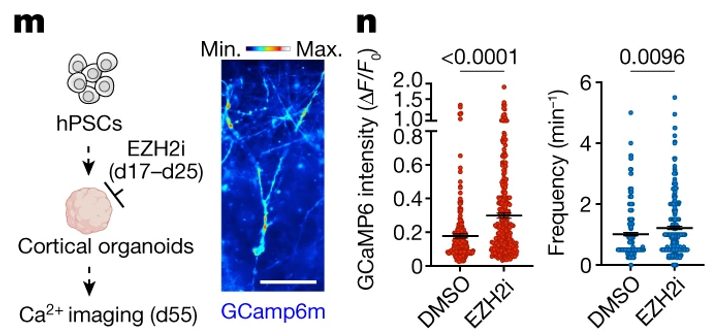
Fig. 4(M,N). NPCs에서 epigenetic factor의 가변적인 억제는 신경세포의 더 빠른 성숙을 유도함
(M) 전뇌 organoid에서의 일시적인 EZH2i에 대한 실험적 개요 및 d55에서의 Ca2+ 이미징의 대표적인 이미지.
(N) organoid에서의 자발적인 Ca2+ 스파이크의 진폭과 빈도.
[Fig 4M, N] organoid 수준에서도 epigenetic inhibitor인 EZH2i 처리에 의해 신경 기능의 발달이 DMSO 처리군 대비 가속화됨.
The epigenetic barrier across species
– 인간의 배아줄기세포와 유사한 마우스의 배반포 줄기세포에서의 성숙 마커 발현 및 epigenetic regulator의 영향을 관찰함.
– 약 20일에 걸쳐 성숙 마커를 점진적으로 상향 조절했으며, epigenetic regulator인 EZH2의 발현이 적었음. 또한, EZH2의 발현을 억제했을 때 성숙 마커가 상향되는 정도도 작았음.
– 이는 마우스 신경세포의 epigenetic barrier가 인간보다 낮음을 일관되게 보여줌.
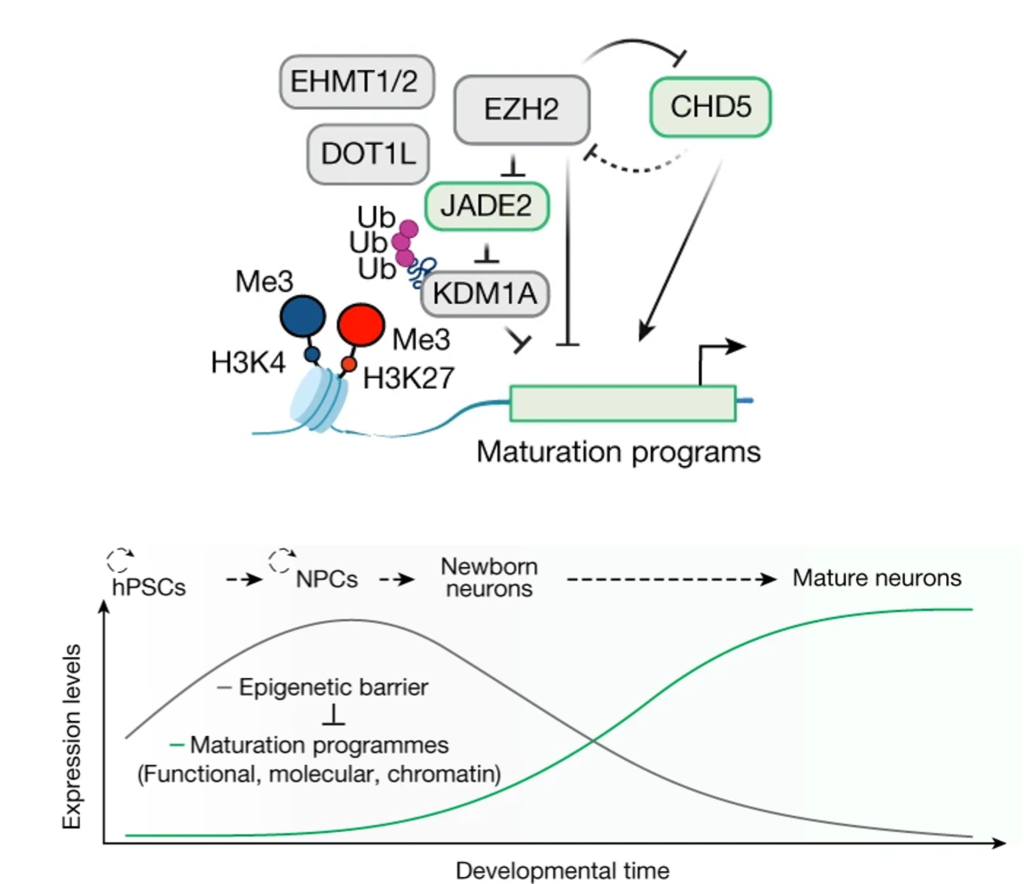
The epigenetic barrier regulates poised genes
– 신경 세포의 성숙에 중요한 특정 유전자들이 *양가성(bivalent) chromatin 상태에서 활성 chromatin 상태로 전환되는 과정을 밝힘.
– EZH2 inhibition을 통해 H3K27me3가 감소하면서 관련 유전자의 발현이 증가해 신경 세포의 성숙을 유발함.
– EZH2와 상호작용하는 chromatin regulating 유전자 JADE2, CHD5가 성숙 기능 가속화에 중요한 역할을 수행.
*양가성(bivalent): 활성화와 억제 표지를 모두 가지는 유전자 영역으로, 주로 발달 초기 단계의 세포나 줄기 세포에서 발견됨. 특히 H3K4me3(활성화 표지)와 H3K27me3(억제 표지)의 결합으로 특징지어짐.
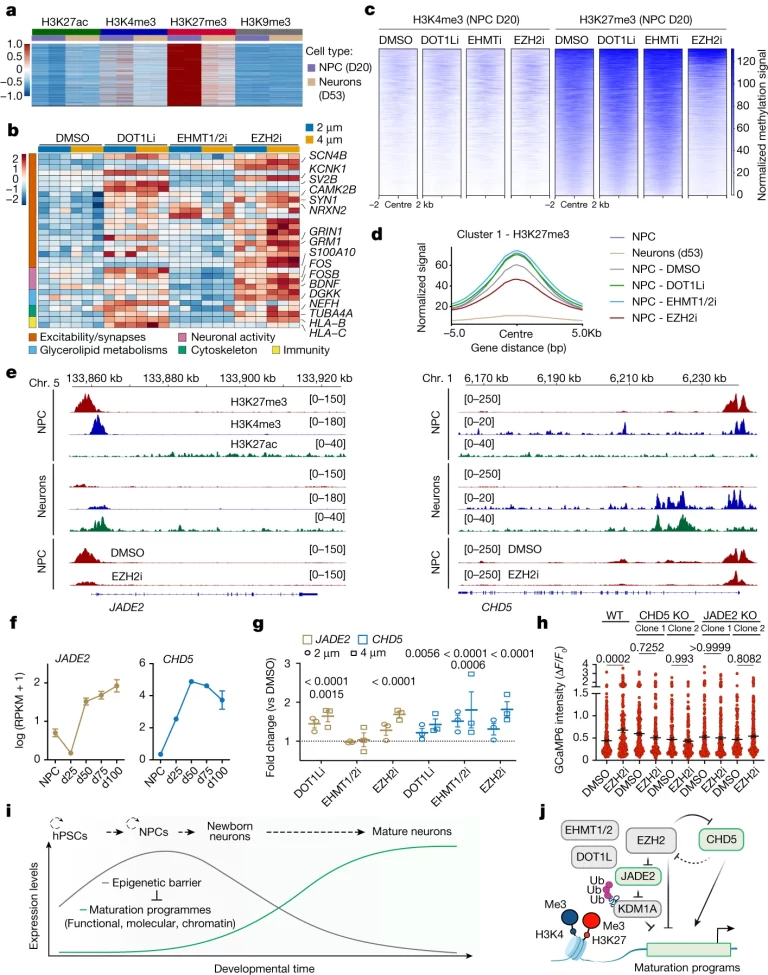
Fig. 5. NPCs에서의 epigenetic barrier가 신경 세포 성숙 프로그램 onset을 제어함
(A) histone modification의 분포를 *CUT&RUN 피크로 분석한 heatmap.
(B) DMSO 또는 epigenetic inhibitor 처리된 NPC에서 유래한 d38 신경 세포의 RNA-seq을 통한 대표적인 양가성 유전자의 normalized expression heatmap.
(C) epigenetic inhibition 후 NPC의 양가성 피크에서 H3K4me3 및 H3K27me3 신호의 normalized tornado plot.
(D) epigenetic inhibitor 처리 NPC, DMSO 처리 NPC, 미처리 NPC 및 신경 세포에서의 양가성 피크에서 H3K27me3의 normalized signal.
(E) 미처리 NPC 및 신경 세포, EZH2i 및 DMSO 처리된 NPC에서 H3K27me3, H3K4me3, H3K27ac의 대표적인 트랙.
(F, G) 성숙 과정 및 d38 신경 세포에서의 epigenetic inhibitor 처리군의 DMSO 처리군 대비 CHD5 및 JADE2 (F) 발현 변화 및 (G) DMSO 대비 fold change.
(H) EZH2i 및 DMSO 조건에서 유래한 WT, CHD5-KO, JADE2-KO hPSC 신경 세포에서 자발적인 Ca2+ 스파이크의 진폭.
(I, J) 연구의 주요 결론. (I) 신경 세포의 발달 과정에 따른 epigenetic barrier 및 성숙 프로그램의 관계, (J) 관련된 분자적 메커니즘.
* CUT&RUN (Cleavage Under Targets and Release Using Nuclease): 특정 단백질 및 modified histone 이 결합한 DNA 위치를 측정하는 분석 기법. 특정 단백질에 결합하는 항체를 사용하여 해당 단백질이 위치한 chromatin region을 특정한 후, 이 영역을 특정 미생물 유래 nuclease(예: Micrococcal Nuclease, MNase)로 절단하고, 이렇게 절단된 chromatin 조각을 분석함으로써 DNA 결합 위치를 정확히 매핑함.
[Fig 5A] NPC에서 양가성 상태로 존재하던 chromatin 구조가 신경 세포로 발달하는 과정에서 H3K27me3의 손실 및 H3K27ac의 획득으로 active chromatin으로 전환됨.
[Fig 5B] 양가성 유전자, 즉 신경 세포 발달 과정에서 활성화되는 유전자로는 신경 조립, 활동 의존적 메커니즘, 글리세롤리피드 대사, 세포골격 성숙, 면역 프로그램 등이 있음.
[Fig 5C] Fig. 5A에서 정상적인 신경 세포 발달에 따라 H3K27me3가 감소한 것과 유사한 변화가 EZH2i 처리 시 관찰됨.
[Fig 5D] H3K27me3의 signal이 EZH2i 처리 시 발달된 신경 세포와 가장 유사하게 억제됨.
[Fig 5E-G] JADE2, CHD5와 같은 chromatin regulating 유전자를 포함한 양가성 유전자들은 신경 세포의 성숙에 의존적으로 발현이 증가하고, EZH2 inhibition에 따라 H3K27me3의 결합이 감소하며, NPC에서 일시적인 epigenetic inhibition에 의해 용량의존적으로 유도됨.
[Fig 5G] 마우스 유래 melanoma cell에 siRNA로 TCF4 silencing을 유도할 경우 세포 및 막 손상이 증가했으며, 이는 증가된 CD8+ T cell의 melanoma cell 살해를 의미함.
[Fig 5H] CHD5 및 JADE2 결핍 hSPAC 유래 신경세포에서는 EZH2 inhibition이 Ca2+ 스파이크 진폭 및 빈도에 미치는 영향이 감소함. 이는 EZH2와 JADE2 또는 CHD5 사이의 기능적 상호작용이 이뤄짐을 뒷받침함.
[Fig 5I, J] hPSCs 유래 신경 세포의 점진적 성숙은 NPC 단계에서 설정된 epigenetic barrier의 유지에 의해 발현되며, epigenetic barrier의 핵심 구성원은 inhibitory histone mark의 침착을 통해 신경 세포 성숙 프로그램을 준비 단계로 유지함.
Disscussion
hPSC 기술은 발달 시기의 메커니즘을 조사하는 새로운 접근법을 제공한다. 여기서는 hPSC에서 대뇌피질 신경 세포의 생성을 동기화하는 방법을 개발하여 신경 세포 성숙 연구를 용이하게 했다. 이 새로운 배양 시스템은 신경세포 기능에 영향을 미치는 것으로 알려진 신경교세포가 거의 없기 때문에 신경세포 내재적 메커니즘을 다루는 데 특히 적합하다. 신경세포 성숙이 아닌 신경 분화에 대한 최근 연구에 따르면 마우스와 인간 PSC를 함께 배양하면 분화 시기를 조절할 수 있다고 한다. 그러나 이러한 키메라 배양에서 타이밍에 영향을 미치는 외부 신호는 아직 명확하지 않다. 마지막으로, 다른 hPSC 기반 방법에 의해 생성된 신경 세포의 성숙률을 비교하고, 성숙한 NMDA 신경전달의 출현을 비교하는 것이 유용할 것이다.
우리의 연구는 여러 성숙 표현형(시냅스, 대사, 면역 관련 및 후성유전학)을 매핑했다. 독립적인 메커니즘이 각 표현형을 조절하는지, 아니면 공유된 시계가 이들의 공동 발현을 조율하는지 여부는 현재로서는 불분명하다. 예를 들어, 미토콘드리아 성숙은 신경세포 성숙의 형태적 측면과 기능적 측면을 모두 조절할 수 있다. 대조적으로, 시냅스 후 SRGAP2A 유전자의 인간 유사체는 조상 유전자 기능을 조절하여 시냅스 형성 및 척추 형태 형성을 연장하는 것과 관련이 있다.
우리의 데이터에 따르면 epigenetic barrier의 높은 발현 수준 및 느린 하향 조절은 인간의 성숙 시기를 연장시키는 것으로 나타났다. 반대로, 더 빨리 성숙하는 마우스 신경 세포는은 epigenetic barrier가 더 낮고 Ezh2 transcripts 수가 더 적은 것으로 보인다. 따라서, 마우스 신경 세포에서 성숙 마커의 유도는 Ezh2 억제를 통해 약간만 강화되며, JMJD3 및 UTX H3K27 탈메틸화 효소의 억제를 통해 epigenetic barrier을 유지하면 성숙을 지연시킬 수 있다. 최근 연구에 따르면 Ezh2, Jmjd3(Kdm6b라고도 함) 및 Utx(Kdm6a라고도 함)의 translation이 마우스 NPC의 운명을 지정하는 시기에 영향을 미치며, 이는 transcription 및 translation 조절이 모두 기여한다는 것을 암시하는 것으로 보고되었다. transcription 개시 대비 단백질 회전율의 뚜렷한 비율은 초기 발달의 종별 시간 척도와 상관관계가 있다. 그러나 인과관계와 신경세포 성숙 등 보다 장기적인 과정에 대한 적용 가능성을 입증하기 위해서는 추가 연구가 필요하다. 에너지 대사와 미토콘드리아 성숙도 종별 성숙 시기에 따라 확장된다. 신진대사와 epigenetic barrier 사이의 상호 작용을 분석하면 성숙 시기의 기저에 있는 메커니즘을 추가로 파악할 수 있다. epigenetic barrier는 여러 종류의 염색질 조절 인자로 구성되어 있으며, 추가 연구를 통해 이들의 상호 작용을 분석해야 한다. 예를 들어, EZH2와 DOT1L은 성숙 유전자의 하위 집합을 조절하는 데 협력한다. 그러나 EZH2를 억제하면 성숙 유전자의 발현이 유도되는 반면, 줄기세포와 연결된 경로인 DOT1L을 억제하면 미성숙 관련 프로그램을 silencing 시킴으로써 성숙을 촉진할 수 있다. 다른 요인으로는 뚜렷한 시간적 역학에 따라 하향 조절되고, 생체 내에서 피질 신경 세포 성숙을 조절할 수 있는 SOX4와 SOX11이 있다.
이 연구의 핵심은 NPC에서 주요 epigenetic 인자(EZH2, DOT1L, EHMT1/2)를 일시적으로 억제하면 유사분열 후 신경세포 성숙을 가속화할 수 있으며, 이는 성숙률이 신경 발생 전에 ‘사전 프로그래밍’되어 있다는 것을 의미한다. 또한, EZH2에 초점을 맞춰 여러 성숙 관련 유전자가 H3K27me3 및 H3K4me3 이중 침착을 통해 NPC에서 전사적으로 준비되어 있음을 발견했다. EZH2 억제를 통해 H3K27me3 수준을 낮추면 많은 성숙 관련 transcripts의 후속 발현이 가속화되었지만, 성숙과 무관한 잠재적인 off-target 효과를 평가하기 위해서는 추가 연구가 필요하다. 성숙 유전자는 신경세포 성숙의 ‘이펙터'(예: 이온 채널 및 시냅스 단백질)와 epigenetic barrier과 ‘경쟁적으로’ 상호작용하는 기타 염색질 조절인자(CHD5 및 JADE2)로 구성된다. 우리의 모델은 성숙 시기를 결정하는 요인으로 억제성 PRC2와 H3K27me3의 방출을 강조하지만, 이는 활성 염색질 관련 인자의 기여를 부정하지는 않는다. 실제로 신경 세포에서 H3K4me3 및 H3K27ac의 증가는 성숙 의존적 전사 및 H3K4 탈메틸화 효소 KDM5 또는 KDM1A의 기능 상실과도 관련이 있으며, 이는 아마도 전체적으로 H3K4 메틸화 수준을 증가시켜 성숙을 부분적으로 촉진할 수 있다.
EZH2 및 H3K27me3 역학은 마우스 피질에서 신경 세포와 신경교세포를 순차적으로 생성하는 NPC의 시간적 능력을 주도하는 것으로 제안되었다. 따라서 organoid에서 일시적으로 EZH2를 억제하면 신경 세포의 기능을 향상시킬 뿐만 아니라 조기에 성상교세포(Astrocytes)의 특이화를 유도할 수 있다. 대뇌피질 NPC에서 EZH2의 하향 조절은 신경 발생 후기 동안 성숙 관련 transcripts의 상향 조절과 관련이 있다. 이는 공유된 epigenetic mechanism이 신경 세포 정체성의 시간적 특이화와 분열 후 성숙의 타이밍을 조율할 수 있는 흥미로운 가능성을 제기한다. 특히, epigenetic barrier의 점진적인 하향 조절은 생체 내에서 마우스와 인간 대뇌피질의 흥분성 및 억제성 신경 세포 하위 유형에 걸쳐 공유된다. 우리 연구는 TBR1+ 심층 뉴런에 초점을 맞추었으며, 상층 뉴런을 포함한 다른 뉴런에서 epigenetic barrier가 성숙 타임라인을 조절하는지 여부를 테스트하기 위한 추가 연구가 필요하다. 마지막으로, 성숙 타이밍을 조작하는 방법은 인간 신경 네트워크의 새로운 특성을 탐색하고 신경학적 질병에서 성인과 같은 신경 기능을 모델링하기 위해 개선된 hPSC 기반 기술을 가능하게 할 수 있다.