인간 Ser/Thr kinome에 대한 기질 특이성의 아틀라스
Abstract
단백질 인산화는 생물학에서 가장 널리 퍼진 번역 후 변형 중 하나입니다. 질량 분석 기반 포스포프로테오믹스 (phosphoproteomics)의 발전으로 지금까지 90,000개의 Ser/Thr 인산화 부위가 확인되었으며 수천 개가 인간 질병 및 생물학적 과정과 관련이 있다는 것이 알려졌습니다. 대부분의 인산화 현상에 대해 인간 게놈에 암호화된 300개 이상의 단백질 Ser/Thr 키나아제 중 어느 것이 원인인지는 아직 알려지지 않았습니다.
이 연구에서는 합성 펩타이드 라이브러리를 사용하여 인간에서 활성화될 것으로 예상되는 것의 84% 이상을 포함하는 303개의 Ser/Thr 키나아제의 기질 서열 특이성을 프로파일링했습니다. 전체적으로 볼 때 kinome의 기질 특이성은 예상보다 상당히 다양했으며 음성 선택도에 의해 광범위하게 구동되었습니다. 우리는 kinome-wide 데이터 세트를 사용하여 인간 Ser/Thr phosphoproteome에서 보고된 모든 인산화 부위를 인산화할 수 있는 키나아제를 계산적으로 주석을 달고 식별했습니다. 관련 추정 단백질 키나아제가 이전에 보고된 소수의 인산화 부위에 대해 우리의 예측은 매우 일치했습니다.
호르몬, 성장 인자, 표적 억제제 및 환경적 또는 유전적 교란에 대한 조직과 세포주의 신호 반응을 조사하기 위해 이 접근법을 적용했을 때 경로 복잡성과 보상에 대한 예상치 못한 통찰력이 드러났습니다. 전반적으로, 이러한 연구는 인간 Ser/Thr kinome의 본질적인 기질 특이성을 밝히고, 세포 신호 반응을 밝히며 인산화를 생물학적 경로에 연결하는 자원을 제공합니다.
Figure
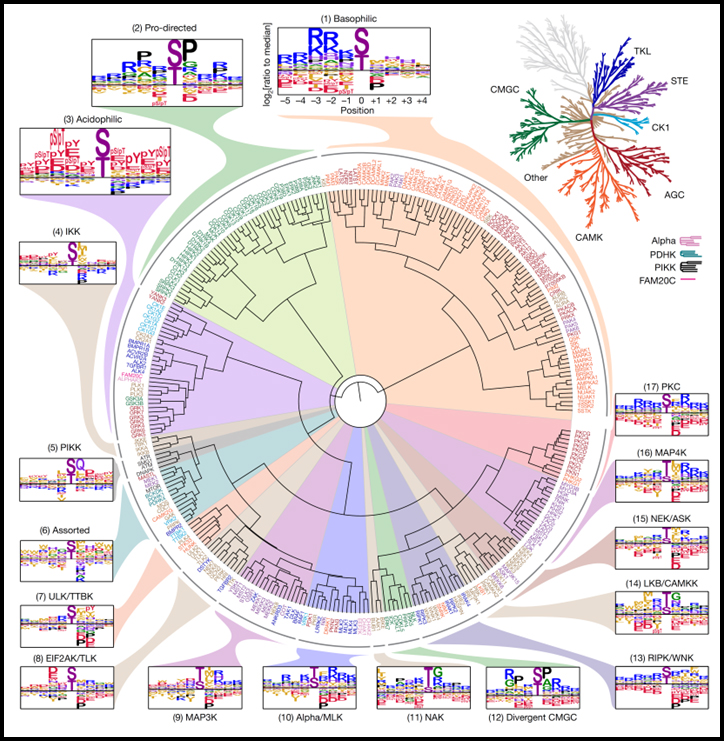
[Figure 1] 인간 Ser/Thr kinome의 기질 특이성 프로파일링.
(A) PSPA 분석 및 대표적인 결과에 대한 실험 워크플로우.
(B) 이 연구에서 분석된 Ser/Thr 키나아제를 강조하는 인간 단백질 kinome의 덴드로그램.
[Figure 2] 인간 Ser/Thr kinome의 인산화 부위 모티프 트리.
아미노산 모티프 선택성 (PSSM)에 기초한 303개의 Ser/Thr 키나아제의 계층적 클러스터링.
[Figure 3] 인간 Ser/Thr kinome에 대한 인산화 모티프를 통한 인간 phosphoproteome의 포괄적인 스코어링 및 주석 작성.
(A) 기판 스코어링 공정의 개략도.
(B) PSSM 및 확립된 키나아제 글리코겐 포스포릴라아제 키나아제의 기질 모티프 로고와 함께 글리코겐 포스포릴라아제 상의 Ser15에 대한 결과.
(C) 확립된 키나아제 ATM과 함께 p53의 Ser15에 대한 결과.
(D) A에 나타낸 바와 같이 수행된 303개의 Ser/Thr 키나아제로부터의 백분위수 점수에 의한 인간 Ser 및 Thr 포스포프로테옴의 주석.
[Figure 4] 글로벌 모티프 분석을 통한 키나아제 섭동 및 경로 재연결과 포스포프로테오믹스 재형성
(A) 포스포프로테오믹스 데이터의 모티프 농축 분석의 워크플로우.
(B-G) 게시된 데이터 세트의 결과.
(B) FAM20C의 유전자 결실 후 HepG2 세포의 컨디셔닝된 배지.
(C) 2μM isoproterenol로 30분 처리 후 배양된 myotubes.
(D) 0.1μM PLK1 억제제 BI2536으로 45분 동안 처리하여 유사분열 정지 시킨 HeLa 세포.
(E) 6Gy의 전리 방사선에 노출된 지 2시간 후의 A549 세포.
(F) 혈청 고갈 후 100nM 인슐린으로 1분 또는 60분 처리 된 3T3-L1 지방세포.
(G) 100ng/ml LPS로 30분 및 4시간 처리 후의 C57BL/6J 마우스 골수 유래 수지상 세포.
Disscussion
이 연구는 인간 Ser/Thr kinome의 기질 모티프의 전체 스펙트럼을 제시하고 그들의 세포 기능을 더 탐구하기 위한 편향되지 않은 포괄적인 프레임워크를 제공합니다. 전 세계적으로 이러한 모티프는 예상보다 훨씬 다양하여 kinome의 기질 레퍼토리가 더 넓음을 시사합니다. 이 데이터 세트의 계층적 클러스터링은 kinome을 최소 38개의 모티프 클래스로 재구성하고 여러 공유 모티프 기능을 도입했습니다.
우리가 프로파일링한 Ser/Thr 키나아제는 거의 예외 없이 특정 모티프 특징에 대해 강력하게 차별적이었습니다. 이러한 결과는 키나아제 신호 전달 경로의 충실도가 대부분의 무관한 키나아제에 의한 인산화를 피하기 위해 기질에 대한 선택적인 압력을 통해 주로 달성되며, 이는 인산화 부위 주변의 아미노산 서열을 비동족 키나아제에 의해 선호되지 않도록 조정함으로써 발생할 수 있음을 시사합니다. 이 음성 선택이 적절한 기질 인식에 실질적으로 기여하기 때문에 키나아제-기질 관계의 정확한 식별에는 키나아제 인산화 모티프에 대한 포괄적인 지식이 필요합니다. 관심 있는 개별 키나아제뿐만 아니라 동일한 풀에서 경쟁할 수 있는 인간 kinome의 다른 모든 키나아제에 대해서도 마찬가지입니다.
이 kinome-wide 데이터 세트를 사용하여 인산화 부위를 둘러싼 아미노산 서열만을 기반으로 기질 인산화를 담당하는 특정 키나아제를 예측할 때 조직 특이성, 스캐폴딩 효과, 세포 내부 국소화 등에 대한 지식 없이도 정확한 키나아제-기질 관계를 식별하는 결과가 매우 정확했습니다. 이러한 추가 정보를 포함하면 예측 접근 방식이 더욱 향상될 것입니다. 이 실험에서 1차 펩타이드 어레이를 사용하는 것의 한계는 기질 펩타이드 내에서 중간 접촉의 기여도를 측정하지 않는다는 것입니다. 이는 이전에 Ser/Thr에 대해서는 덜하지만 일부 Tyr 키나아제에 대한 기질 선택에 영향을 미칠 수 있음을 보여주었습니다. 또한 Ser 또는 Thr 잔기의 위치 선택과 인접 잔기 (예: 하나 이상의 인 수용체를 포함하는 펩티드)의 직접적인 인산화를 구별할 수 없었습니다. 키나아제 기질 모티프 데이터에 의해 안내되는 구조 모델링 접근법은 잠재적으로 이 추가 정보를 해독하여 예측을 더욱 향상시킬 것입니다.
이 모티프의 글로벌 컬렉션을 사용하여 MS phosphoproteomic 데이터 세트를 조사한 결과 잠재적인 생물학적 통찰력과 추정 키나아제 기질이 산출되었습니다. 예를 들어, 전리 방사선에 노출된 세포에서 ATM은 상향 조절된 37개의 인산화 부위를 표적으로 삼을 것으로 예측되었으며, 그 중 대부분은 ATM의 기질로 연관되지 않았습니다. 인간 임상 샘플과 질병 모델 시스템에 대한 포스포프로테오믹스의 적용이 계속 발전함에 따라 우리의 포괄적인 모티프 기반 접근 방식은 인간 질병 진행, 항암제 내성 메커니즘, 식이 개입 및 기타 중요한 생리학적 개입 프로세스의 기초가 되는 복잡한 신호를 해명할 수 있는 고유한 장비를 갖추게 될 것입니다. 요약하면, 우리는 이것이 인간 생물학 및 질병의 신호 경로를 연구하는 광범위한 연구자에게 귀중한 자원을 제공할 것으로 예상합니다.