자기 조직화된 조직 역학이 배아 조절의 핵심적인 역할을 하며 분열에 기초가 됩니다.
Abstract
초기 양막류(Amniote) 발달은 높은 수준의 자기 조직화(self-organization) 능력을 가지고 있으며, 국소적 및 장거리 세포 간 상호작용을 통해 외부 간섭에 적응할 수 있습니다. 이러한 과정은 *배아 조절(embryonic regulation)*이라고 불리며, 이는 조류 배아(avian embryos)를 대상으로 한 실험에서 잘 설명되었습니다. 이 실험에서는 배반엽 디스크(epiblast disk)를 여러 부분으로 나누었을 때 세포 운명이 재조정되어 원래 위치에서 완전하고 균형 잡힌 배아가 형성될 뿐만 아니라, 분리된 다른 부분에서도 추가적인 완전한 배아가 자기 조직화되는 현상이 관찰되었습니다.
배아 자기 조직화에 관여하는 세포 간 상호작용은 분자 신호에 의해 매개된다고 널리 여겨지지만, 그 신호의 정체는 명확하지 않았습니다. 여기에서 메추라기 배아(quail embryos)를 대상으로 한 분석을 통해, 배아 발생을 주도하는 기계적 힘(mechanical forces)이 스스로 조직화된다는 것을 보여줍니다. 구체적으로, 수축(contractility)은 국소적으로 자기 활성화되며, 생성된 장력(tension)은 장거리 억제자(long-range inhibitor)로 작용합니다. 이러한 기계적 피드백은 배아 형태를 결정하는 조직 흐름 패턴을 지속적으로 유지하고, 동시에 유전자 발현을 조절하여 배아 영역의 형성을 유도합니다. 이는 정상적인 조건에서는 단일 배아가 형성되도록 보장하지만, 간섭이 있을 경우 여러 개의 잘 균형 잡힌 배아가 형성될 수 있도록 합니다.
결론적으로, 기계적 힘은 배아 자기 조직화의 핵심에서 조직과 유전자 발현을 형성하여 초기 발달을 견고하면서도 유연하게 조정합니다.
Figures
The redirection of cell fates to form ectopic embryos in chicken epiblast subdivision experiments has been shown to involve GDF1
– 닭의 상배엽 분할 실험에서 세포 운명이 전환되어 외부 배아(ectopic embryo)가 형성되는 과정에는 GDF1이 관여하는 것으로 나타났다
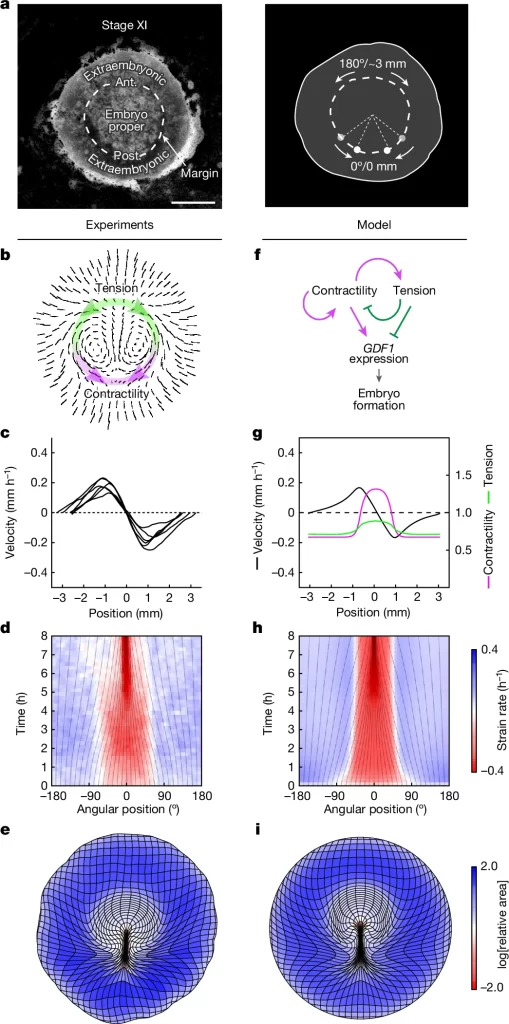
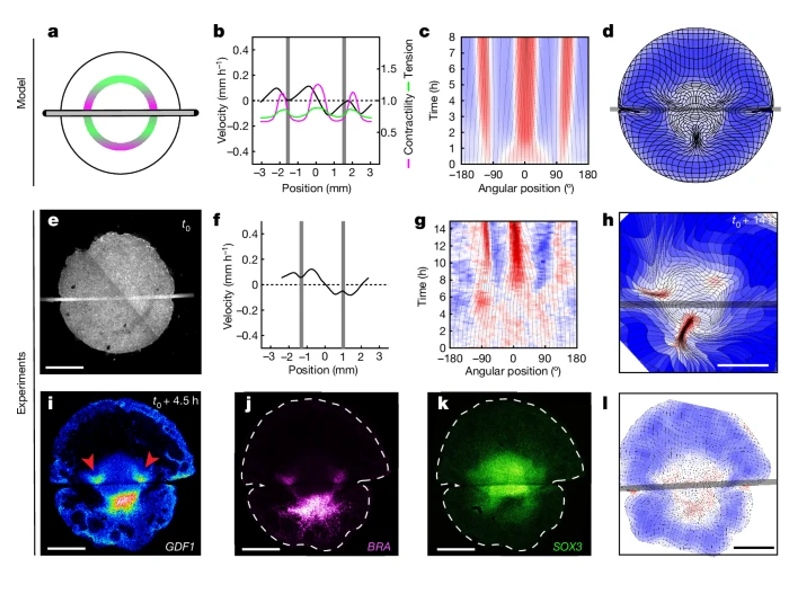
Fig. 1. 배아 가장자리에서의 자기 조직화된 힘 생성 모델
(a) 스테이지 XI 메추라기 배아의 투과광 이미지로, 배아 영역(왼쪽)과 조직 운동을 정량화하기 위해 가장자리의 밀리미터 및 각도 위치(화살표, 오른쪽)가 표시됨. Ant., 앞쪽(anterior); Post., 뒤쪽(posterior).
(b) 조직 운동이 시작된 후 t = 6–8시간에 입자 이미지 속도계(PIV) 분석으로 얻어진 조직 흐름의 궤적. 중첩된 색상은 능동 수축성(자주색, 뒤쪽에서 가장 높음)과 그로 인해 생성된 장력(녹색, 가장자리에서 대체로 균일함)을 나타냄.
(c) 이전 연구6에서 얻은 생물학적으로 독립된 배아(n = 6)의 가장자리를 따라 측정된 속도 프로파일(t = 4시간). 0mm는 뒤쪽, 약 ±3mm는 앞쪽임.
(d) 가장자리에서 변형률(스트레인) 속도의 시간적 변화. 회색 선은 각 위치의 각도 변화(진화)를 나타냄. 0°는 뒤쪽, ±180°는 앞쪽임.
(e) 6개의 배아 평균 데이터를 바탕으로 한 초기 사각형 격자의 변형.
(f) 능동적인 수축성(자주색)과 수동적인 장력(녹색) 간의 상호작용이 GDF1 발현을 통해 배아 형성을 조절한다고 제안함. 실선 화살표는 조직 수축 대 스트레칭에 대한 반응으로 인한 국소 피드백을 나타냄(Extended Data Fig. 1 참조). 점선 화살표는 장거리 장력 전파를 나타냄.
(g) t = 4시간에 예측된 수축성(자주색), 장력(녹색), 속도(검정색)의 프로파일.
(h) 가장자리에서 변형률 속도의 시간적 변화.
(i) 자기 조직화된 수축성이 2D 유체 역학 모델에 구현되었을 때의 전역적인 조직 변형.
d, h, e, i의 색상: 수축(빨간색) 및 확장(파란색)을 정량적으로 나타냄.
축척: a의 경우 1mm.
[Fig 1A-C] 배아의 외배엽 영역 사이의 후방 가장자리에 발현하는 GDF1을 타겟팅하기 위해 영역을 정리하였음. 해당유전자는 TGF-β에 속하는 유전자임. 배아 가장자리에서 supracellular actomyosin링이 형성되며, 그 수축 활동이 배아의 초기 형태를 형성하는 대규모 회전 조직 운동을 이끌어낸다는 것을 보여줌.
[Fig 1D] 배아 가장자리에서 속도 프로필과 변형 속도의 시간적 진화를 통해, 후방에서는 비교적 균일한 수축, 전방에서는 늘어나는 두 영역 패턴이 나타남. 조직은 지속적으로 후방으로 수렴하면서도 비율은 안정적으로 유지되었음
[Fig 1E] 이 그림은 2D 유체-역학 모델을 사용하여 배아 가장자리에서 자가 조직화된 수축성이 어떻게 조직 운동 패턴을 재현하는지를 보여줌. 이 모델은 원시선(primitive streak) 형성까지 이어지는 조직 운동 패턴을 정확히 재현하며, 이는 배아의 주요 축 형성의 중요한 지표임.
[Fig 1F] 이 가능성을 검토하기 위해, 우리는 수축 영역에서는 수축성이 증가하고 늘어나는 영역에서는 수축성이 감소하는 장력선으로 가장자리에서 힘 생성 조절을 위한 1차원 모식도를 구축함.
[Fig 1G] 이 그래프는 배아 가장자리에서 조직의 속도 프로필을 나타내며, 배아가 시간에 따라 어떻게 변형되는지 보여줌. 검은 곡선은 조직의 이동 속도 패턴을 시각적으로 표현하며, 이는 모델에 의해 예측된 조직 운동을 반영함.
[Fig 1H] 이 그림은 배아 절단 후 수 시간 동안 조직이 어떻게 변형 되는지를 보여주는 변형 지도임. 그림에서는 활성 수축 영역과 수동적으로 늘어난 영역이 시간에 따라 어떻게 안정적인 비율로 유지되는지, 그리고 조직이 어떻게 이동하는지를 시각적으로 나타남
[Fig 1E-I] 이 그림은 2D 유체-역학 모델을 사용하여 배아 가장자리에서 자가 조직화된 수축성이 어떻게 조직 운동 패턴을 재현하는지를 보여줌. 이 모델은 원시선(primitive streak) 형성까지 이어지는 조직 운동 패턴을 정확히 재현하며, 이는 배아의 주요 축 형성의 중요한 지표임.
Tissue contractility regulates GDF1
– 조직의 수축성이 GDF1 발현을 조절합니다
– 조직의 수축을 조절화는 myosin을 억제하는 calyculin-A와 H1152를 처리하였을때 수축성에 따라 GDF 발현 정도가 차이가 나는것이 확인되었습니다.
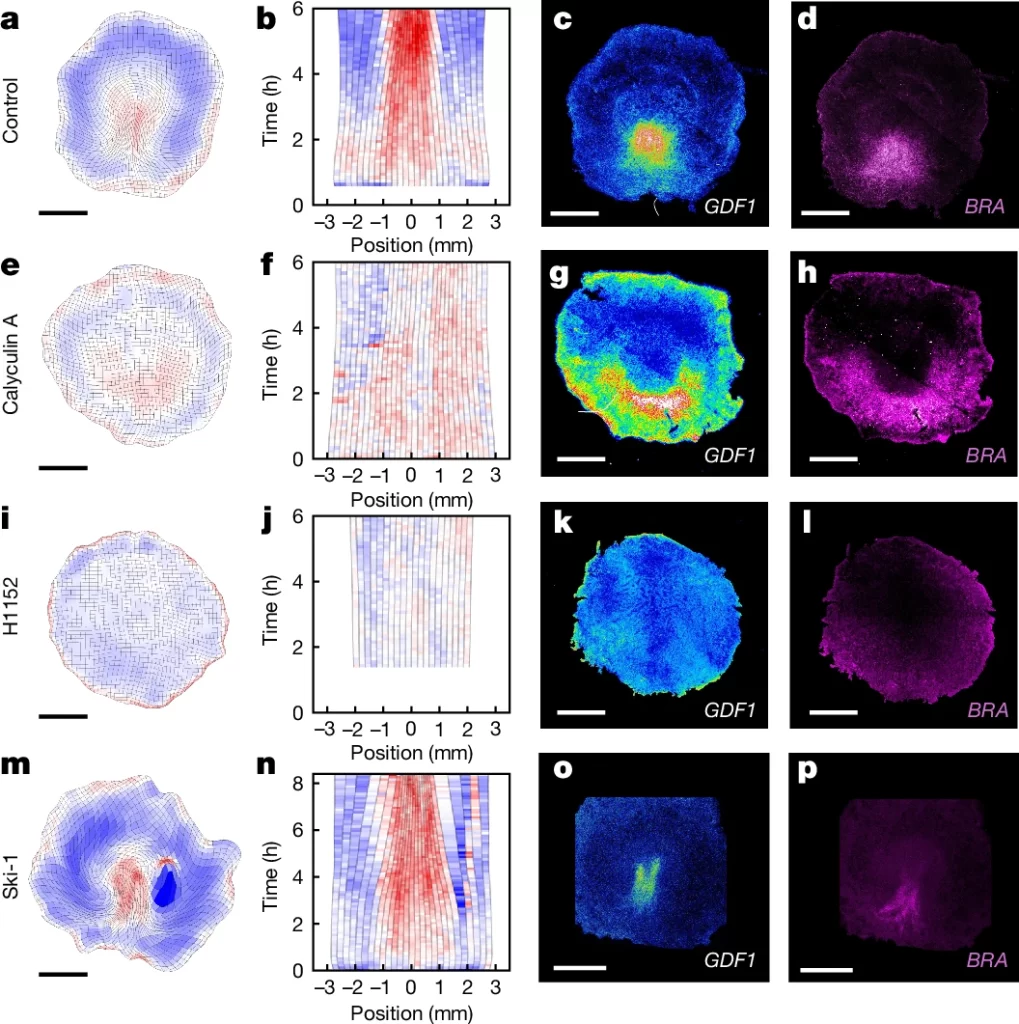
Fig. 2. 조직 수축성이 GDF1 발현을 조절함
(a–f,) 조직 변형 지도(a, e, i, m), 가장자리에서 변형률 속도의 시간적 변화(b, f, j, n; 0mm는 뒤쪽), 그리고 GDF1(c, g, k, o) 및 BRA(d, h, l, p) 발현을 대조군(a–d; n = 32), Calyculin-A 처리군(e–h; n = 18), H1152 처리군(i–l; n = 13), Ski-1 처리군(m–p; n = 6)의 생물학적으로 독립적인 배아에서 분석.
a, b, e, f, i, j, m, n에서 색상은 수축(빨간색) 및 확장(파란색)을 정량화.
축척: 1mm (a, c, d, e, g, h, i, k, l, m, o, p).
[Fig. 2a-d] 대조군의 조직의 변형정도와 시간에 따른 변형률 속도 확인을 통해 일반적인 배아의 상태를 확인함. GDF1 및 BRA 발현 패턴 확인을 통해 축 초기 형성 마커들의 패턴을 볼 수 있음.
[Fig. 2e-h] 칼리쿨린-A로 처리된 배아. GDF1 발현이 앞쪽까지 확장되었으며, BRA 발현도 이에 맞춰 넓게 확장된 것을 볼 수 있음. 조직 변형 정도에도 변화가 생긴것을 확인할 수 있음.
[Fig. 2i-l] H1152로 처리된 배아. GDF1 및 BRA 발현이 완전히 억제된 상태를 보여줌. 전체적인 조직 변형도에서도 수축성 신호가 나타나지 않은것으로 보임
[Fig. 2m-p] Ski-1로 처리된 배아. GDF1 및 BRA 발현이 불규칙하게 나타나며, 가끔은 뒤쪽에서 두 개의 원시선이 형성된걸 볼 수 있으며 수축성 신호도 약하게 나타남.
Without tension, two ectopic contraction foci form at the posterior margin due to a contractility bias.
– 전달된 장력이 없으면, 수축성 편향으로 인해 후방 가장자리에 두 개의 이소성 수축 초점이 형성됩니다
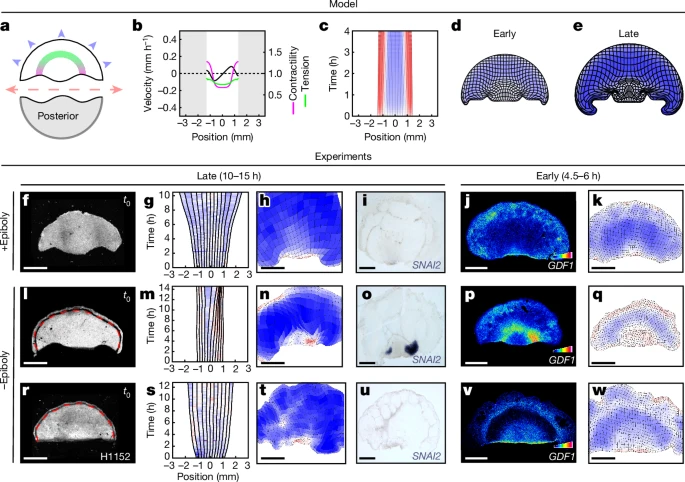
Fig. 3: 자기 조직화된 조직 역학이 배반엽 분할 후 이소성 배아 형성을 유도.
(a–e) 상배엽 전반부 절단에 대한 반응에 대한 모델 예측.
(a) 상배엽 절단의 스케치.
(b–e), 절단 후 4시간(t0 + 4 h)의 예측된 수축성(자주색), 장력(녹색), 속도(검정색) 프로필(b), 가장자리 변형 속도의 키모그래프(c; 0 mm는 전방), 그리고 4시간(d) 및 8시간(e) 후 변형 지도.
(f–w), UV 레이저로 절단된 상배엽 전반부. 배외배엽(epiboly)이 있는 경우(f–k)와 없는 경우(l–w), 그리고 H1152 처리된 경우(r–w). 붉은 점선은 배외배엽 과정을 중단시키는 UV 절단을 나타냅니다.
(f,l,r, t) 0 시점의 memGFP 배아.
(g,m,s,) 가장자리 변형 속도의 키모그래프; 0 mm는 전방.
(h,n,t), 상배엽 절단 후 10시간
(h), 15시간(n), 및 13시간(t)의 변형 지도.
(i,o,u), 실시간 이미징 후 고정된 동일한 배아에서의 SNAI2 발현(n = 8/8 생물학적으로 독립적인 배아, 배외배엽 존재; n = 5/5, 배외배엽 없음(5개 중 3개는 두 개의 이소성 원시선, 2개는 하나의 이소성 원시선 형성); n = 4/4, 배외배엽 없음 및 H1152 처리됨).
(j,k,p,q,v,w) 상배엽 절단 후
(j,k,p,q)4.5시간 및(v,w) 6시간 시점에서의 GDF1 발현과 해당 변형 지도.
스케일 바, 1 mm
[Fig. 3a-e] 절단된 배아에서 수축 초점이 자발적으로 형성되는 모습을 보여줍니다. 후방에서 수축 기울기가 존재하면, 가장자리에서 두 개의 자가 지속적인 수축 초점과 두 개의 스트릭이 발생합니다. 이 현상은 장력 전파가 중단된 후에 나타나는 것입니다.
[Fig. 3f-k] 절단된 앞부분에서 GDF1과 SNAI2 발현을 분석한 결과, 수축 초점이 나타나지 않았음을 보여줍니다. 이 실험에서는 앞부분이 절단된 후 GDF1 또는 SNAI2의 발현이 나타나지 않았으며, 이는 앞부분이 수축하지 않아서 자발적인 원시 스트릭 형성이 일어나지 않음을 보여줍니다.
[Fig. 3g-h] 절단된 앞부분의 배아 조직이 비정상적으로 늘어나는 모습을 보여줍니다. 이 그림에서는 배엽의 가장자리가 늘어나며, 확장된 조직은 청색으로 표시되어 있습니다. 이는 수축되지 않은 조직이 확장되는 현상으로, 수축이 일어나지 않으면 원시 스트릭 형성이 방해된다는 것을 의미합니다.
[Fig. 3I] 배엽이 이동하는 가장자리를 다른 부분에서 분리하는 레이저 절단을 사용하여, 에피볼리가 방해되었을 때 수축 초점이 빠르게 형성되는 모습을 보여줍니다. 점선 빨간선은 배엽 가장자리와 다른 영역을 분리한 부분을 나타냅니다
[Fig. 3m-q] 에피볼리가 방해된 앞부분에서 수축 초점이 형성되고, GDF1 발현이 나타나며, 이후 원시 스트릭(SNAI2 발현)을 형성하는 과정을 보여줍니다. 에피볼리가 방해된 조건에서 수축 초점과 원시 스트릭이 형성되는 과정이 설명됩니다.
[Fig. 3r-w] H1152와 칼리큘린 A를 사용하여 배엽을 처리한 후의 실험 결과를 보여줍니다. H1152 처리에서는 수축이 일어나지 않으며, GDF1 발현 및 원시 스트릭 형성이 일어나지 않습니다. 반면 칼리큘린 A 처리에서는 에피볼리의 영향을 극복하고 수축이 발생하여 원시 스트릭이 형성됩니다.
Posterior embryonic regulation by adjusting tension via contraction and stretching
이전 연구에 따르면 primed-hiPS 세포의 epigenetic memory와 aberrations은 differentiation 후에도 지속될 수 있으며, 이는 resulting cells에 기능적으로 영향을 미칠 수 있음.
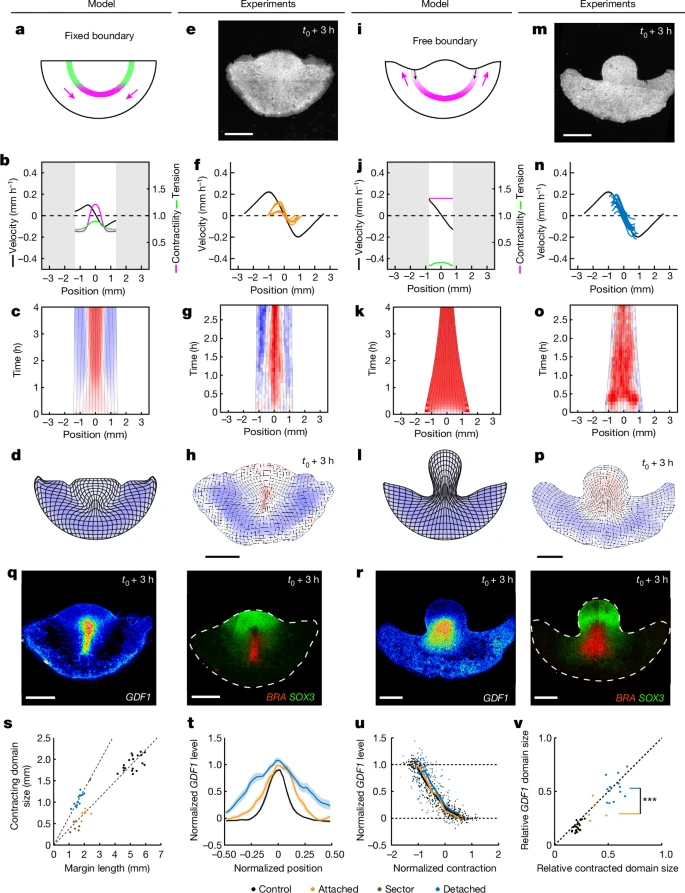
Fig. 4. 기계적 피드백이 배아 영역을 재조정함
(a–p), 뒤쪽 배반엽 절반에서 고정 및 자유 경계 조건에 대한 모델 예측(a–d 및 i–l)과 실험적 반응(e–h 및 m–p)
(a, e, i, m) 실험 스케치(a, i) 및 3시간 후 memGFP 뒤쪽 배반엽 절반(e, m).
(b, f, j, n) t0 + 2 h에서 가장자리를 따라 측정된 수축성(자주색), 장력(녹색) 및 속도(검정색)의 예측 및 실험 프로파일(f 및 n에서 검정선은 평균 ± 표준오차를 나타내며, n = 19 대조군 독립 배아, Extended Data Fig. 5b 참조; 주황색은 n = 6 독립 배아; 파란색은 n = 13 독립 배아).
(c, g, k, o) 가장자리의 변형률 속도 키모그래프.
(d, h, l, p)실험 및 시뮬레이션 종료 시점(t0 + 3–4 h)의 변형 지도.
(q, r, e–h) 및 m–p에 나타난 배아의 GDF1, BRA 및 SOX3 mRNA 발현, 라이브 이미징 후 고정.
(s) 대조군(검정, n = 19 독립 배아), 부착된 절반(주황, n = 6 독립 배아), 더 작은 부착 영역(갈색, n = 6 독립 배아, Extended Data Fig. 6a–c 참조) 및 분리된 절반(파란색, n = 13 독립 배아)의 수축 영역 크기 대 전체 가장자리 길이. 점선은 대조군 및 부착 절반/영역에서 0.37(R = 0.97), 분리된 절반에서 0.65(R = 0.90)의 기울기를 나타냄.
(t) 다양한 조건에서 가장자리의 GDF1 mRNA 신호 강도 프로파일(색상은 s와 동일; Extended Data Fig. 5g에서 수축, BRA 및 SOX3 프로파일 참조; 강도 프로파일은 가장자리 길이에 대해 정규화됨). 데이터는 평균 ± 표준오차로 표시됨.
(u) 가장자리의 특정 부분에서 수축에 따른 GDF1 수준(방법 참조; 실선은 각 조건의 평균을 나타냄; 색상은 s와 동일).
(v) GDF1 영역의 상대적 크기 대 수축된 영역의 상대적 크기(방법 참조; R = 0.91, ***P = 0.0003, 단측 순열 검정, n = 106 랜덤 순열; 색상은 s와 동일).
축척: 1 mm(e, h, m, p, q 및 r).
[Fig. 4a–d] 후방 절반 배엽의 기계적 모델링에서, 수축과 늘어나는 영역의 비율이 초기 상태에서의 장력에 따라 조정되며, 이들 영역은 홈오스테이시스를 회복하려는 경향을 보입니다. 모델에 따라, 배엽의 후방 절반이 재부착되었을 때, 수축과 늘어나는 영역이 균등한 비율로 크기를 맞추는 경향을 보이며, 이는 원시 스트릭이 새로운 배엽 크기에 맞게 재조정되는 과정을 시뮬레이션을 통해 보여줍니다.
[Fig. 4e–g, s] 배엽 절반이 재부착되었을 때, 수축과 늘어나는 영역은 새로운 배엽 길이에 맞게 비율을 조정하여 원시 스트릭이 적절하게 크기를 맞추는 과정을 확인할 수 있습니다. 원시 스트릭은 후방 영역에서 수렴적 확장을 하며 새로운 배엽 크기에 맞춰 조정됩니다.
[Fig. 4h] 배엽이 재부착되었을 때, 원시 스트릭의 크기는 새로 설정된 배엽의 크기에 따라 비례적으로 조정됩니다. 이 과정은 수축과 늘어나는 영역의 비율 조정과 밀접하게 연관되어 있습니다.
[Fig. 4i–l] 배엽의 경계가 자유롭게 남아있는 경우, 수축이 전체 가장자리로 확산되며 원시 스트릭은 크기를 재조정하지 못합니다. 이는 기계적 경계 조건에 따라 원시 스트릭 형성의 규명에 중요한 차이를 나타냅니다.
[Fig. 4n–p, s] 자유 경계의 배엽 절반에서는 수축이 가장자리에 따라 빠르게 확산되고, 원시 스트릭의 크기는 재조정되지 않음을 보여줍니다. 이 실험 결과는 자유 경계가 수축의 방향을 제어하는 중요한 역할을 한다는 것을 나타냅니다.
[Fig. 4q] 배엽 절반에서 경계가 재부착된 경우, SOX3+ (신경 외배엽) 영역과 BRA+GDF1+ (중배엽 및 내배엽) 영역이 좁아지는 현상이 3시간 내에 관찰됩니다. 이는 재부착된 배엽에서 수축이 일어나면서 유전자 발현이 조정되는 과정을 시사합니다.
[Fig. 4r] 배엽의 자유 경계가 있는 경우, BRA+GDF1+ 중배엽 영역의 비율이 SOX3+ 외배엽 영역을 대체하면서 확장됩니다. 이는 자유 경계가 존재할 때의 유전자 발현 변화 양상을 보여줍니다.
[Fig. 4t] SOX3, BRA, GDF1의 발현 수준을 가장자리의 상대적 위치에 따라 정량화한 결과, GDF1 발현은 재부착된 배엽 절반에서 자유 배엽 절반보다 좁은 영역에서 발현되는 것이 확인되었습니다. 이는 배엽이 재부착되었을 때 GDF1 발현이 더 집중되는 경향을 나타냅니다.
[Fig. 4u] 수축의 통합 변화를 기준으로 GDF1 발현 수준을 분석한 결과, GDF1 발현은 일정한 변형 이력을 가진 영역에서 선형적인 관계를 보였습니다. 이는 배엽에서 수축과 늘어나는 패턴이 GDF1 발현에 어떻게 영향을 미치는지 이해하는 데 중요한 통찰을 제공합니다.
[Fig. 4v] ‘수축된 영역’을 통합된 수축을 기준으로 정의했을 때, 이 영역의 상대적인 크기는 GDF1 영역의 상대적인 크기를 예측하는 데 중요한 지표가 됩니다. 이는 수축의 정도가 GDF1 발현의 패턴을 예측하는 데 유효하다는 것을 보여줍니다.
Mechanical self-organization in avian development tested with localized friction using a hair across the epiblast
기계적 자기 조직화는 약한 마찰을 통해 초기 조류 발달의 자기 조직화 특성을 재현할 수 있습니다.
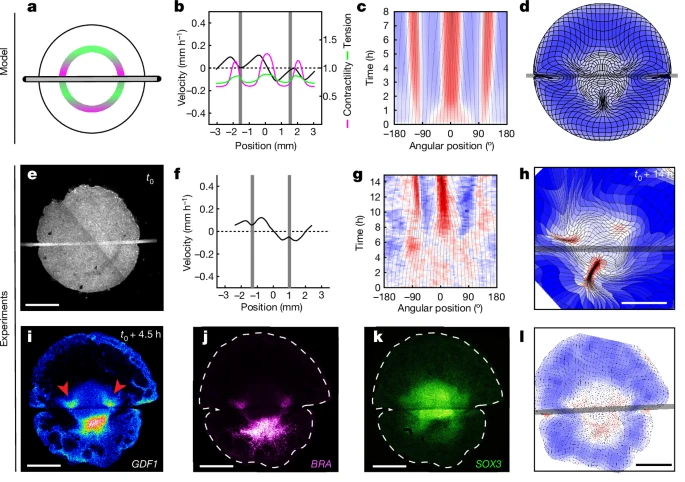
Fig. 5.마찰이 조직 운동 및 축 형성을 재조정하여 이소성 배아 형성을 유도함
(a–d) 국소 장력 실험에 대한 모델링 반응
(a) 머리카락을 중앙에 올린 배아의 장력 형성 모식도
(b,f,) t0 + 4 h에서의 경계선에서의 수축성 (마젠타), 장력 (녹색) 및 속도 (검은색) 프로파일; 0 mm는 후방을 의미.
(c,g), 경계선 변형률의 키모그래프; 0°는 후방을 의미.
(d,h) 8h 및 14 h 에서의 변형 맵. n = 34개의 생물학적으로 독립적인 배아 중 33개.
(i–k), GDF1 (i; 화살표가 비정상 발현을 가리킴), BRA 및 SOX3
(I) 4.5 h후의 해당 변형 맵. n = 15개의 생물학적으로 독립적인 배아. c, d, g, h 및 l의 색상은 수축(빨간색) 및 팽창(파란색)을 정량화함
척도 바, 1 mm
[Fig. 5a, e] 배엽에 마찰을 도입하기 위해, 머리카락이나 나일론 와이어를 배엽에 걸쳐 놓았습니다. 이 탄력은 조직 운동을 완전히 멈추지 않고, 조직의 흐름을 늦추는 역할을 하여 긴장 전파를 방해하는 장애물로 작용합니다.
[Fig. 5b–d] 모델에서 예측한 대로, 탄력이 적용된 앞부분에서 두 개의 수축 초점이 빠르게 나타나 원시 스트릭으로 길어졌습니다. 이들은 마찰이 적용된 부분 바로 앞에서 나타나며, 기존의 수축 영역은 새로운 기계적 경계를 맞추기 위해 좁아졌습니다.
[Fig. 5f–h] 탄력이 적용된 부분에서 원시 스트릭을 포함하는 수축 초점이 나타났습니다. 그 결과, 원시 스트릭의 형성이 탄력이 적용된 지점에서 시작되며, 배엽의 뒤쪽에서는 새로운 경계를 따라 수축 영역이 좁아지는 현상을 보였습니다.
[Fig. 5i, k] 탄력이 적용된 부분에서 GDF1 발현이 나타났고, 이는 원시 스트릭이 형성되기 전에 발생합니다. 이 발현은 4.5시간 후에 관찰되었습니다.
[Fig. 5j, k] SOX3+ (신경 외배엽)와 BRA+ (중배엽 및 내배엽) 영역의 발현은 마찰이 적용된 배엽의 앞부분에서 재조정되었습니다. 4.5시간 후, 배엽의 영역들이 새로운 기계적 경계를 반영하여 재조정되었습니다
Disscussion
Hans Driesch는 조절을 생명체가 정상 상태로 회복되는 일련의 사건으로 정의하며, 생명체의 부분 간에 소통이 이루어짐을 암시했습니다. 그러나 Driesch는 이 소통의 본질을 구체적으로 설명하지 못했고, 이후 연구들은 주로 분자적 상호작용에 초점을 맞추었습니다. 우리의 실험에서는 교란에 대한 가장 초기 반응이 힘 생성과 조직 운동의 재조정임을 확인하였고, 이는 이후에 일어나는 유전자 발현 변화를 예고하는 역할을 합니다. 실제로, 온전한 배아를 형성하는 조직 흐름의 전체 패턴과 교란에 대한 반응은 순전히 기계적 피드백에 기반한 모델로 설명될 수 있습니다. 특히, 기계적 경계 조건이 조직 운동과 유전자 발현의 재조정에 중요한 역할을 한다는 점은 기계적 힘이 배아 자기 조직화에서 유전자 발현의 상류에서 작동하는 주요 신호임을 명확히 보여줍니다. 따라서 배아 조절은 일종의 기계적 항상성으로 이해될 수 있습니다. 배아 자기 조직화에서 역학의 중요성은 오랫동안 제기되어 왔습니다. 우리의 모델에서는 기계적 장력이 수축성을 조절하는 빠르게 전파되는 장거리 신호로 작용합니다. 이는 이전에 제안된 배아 상피의 세포 극성화 모델과 유사하지만, 이번 연구에서는 안정적인 세포 상태 배열이 아니라 수축성의 정상 패턴과 지속적인 조직 흐름이 강조되었습니다. 이러한 발견은 기계적 힘의 자기 조직화와 유전자 조절 특성이 결합되어 배아 조절을 가능하게 함을 시사합니다. 또한, 기계적 힘이 유전자 발현에 미치는 영향은 기계감응성 β-카테닌 경로를 통해 전달된다는 점을 제안합니다. 결론적으로, 자기 조직화된 조직 역학은 자발적인 대칭 깨짐을 지원할 수 있지만, 정상 발달에서 최초의 대칭 깨짐 사건 자체를 설명하지는 못합니다. 조직 역학은 초기 축 형성의 트리거라기보다는 일정 시간 동안 작동하는 정규화 피드백으로 기능하며, 이를 통해 발달이 해로운 편차로부터 보호됩니다. 이는 기계적 신호와 분자적 신호 간의 높은 상호 의존성을 보여주는 중요한 사례입니다.