Mitochondrial complex I은 신장암 전이를 유도한다
Abstract
대부분의 신장암은 대사적인 문제를 동반하지만, 이러한 대사 기능 이상이 인간의 암 진행에 어떤 영향을 미치는지는 알려져 있지 않습니다.
이 연구에서는 신장암 수술 중 80명 이상의 환자에게 13C를 레이블링한 영양소를 주입했습니다. [U-13C]glucose로부터 유래한 레이블링이 신장암의 아형에 따라 달라지며, 이는 신장 환경 자체만으로 모든 신장암의 대사 재프로그래밍(metabolic reprogramming)을 설명할 수 없다는 것을 의미합니다. 정상 신장 조직과 비교했을 때, 투명세포 신세포암(clear cell renal cell carcinomas; ccRCC)은 in vivo 및 ex vivo에서 TCA 회로(tricarboxylic acid cycle) 중간체의 표지가 억제되었습니다. 이는 이러한 억제 현상이 암 조직 자체의 특징임을 의미합니다.
이후 환자들에게 [1,2-13C]acetate와 [U-13C]glutamine을 주입하고, 신장과 종양의 미토콘드리아에서 호흡 과정을 측정한 결과, ccRCC에서 전자전달계 활동이 감소하면서 산화적 TCA 회로의 표지는 줄고, 반대로 환원적 TCA 회로의 표지는 증가하는 것을 확인했습니다. 그러나 전이된 ccRCC 종양에서는 원래의 종양보다 TCA 회로의 표지가 증가하여, 전이 과정에서 대사 프로그램이 변화한다는 것을 알 수 있었습니다.
쥐 실험을 통해 신장암 세포의 호흡이나 NADH recycling을 자극하면 전이가 촉진되지만, 반대로 전자전달계 복합체 I을 억제하면 전이가 감소하는 것이 확인되었습니다. 이러한 연구 결과는 신장암의 진행 과정에서 대사적 특성과 취약점이 변화하며, 미토콘드리아 기능이 원래의 종양 성장보다는 전이 과정에서 더 중요한 역할을 한다는 것을 보여줍니다.
Figures
Kidney cancers use glucose variably
암세포 및 정상세포의 포도당 대사 과정 중 TCA cycle을 활용하여 대사 산물의 축적량을 비교하는 방식으로 세포 간 기능적 차이 제시.
![[Fig1] Mitochondrial complex I promotes kidney cancer metastatis](https://scienceeasyview.com/wp-content/uploads/2024/08/Fig1-Mitochondrial-complex-I-promotes-kidney-cancer-metastatis.png)
[Figure 1] 포도당 대사 과정은 신장암 종류에 따라 다르다.
(a) 수술 중 영양소 주입 방식을 설명한 모식도.
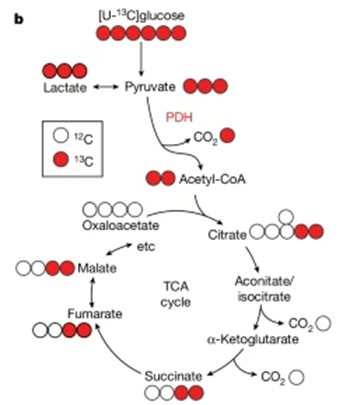
(b) [U-13C]포도당이 PDH를 통해 TCA 회로에 들어가는 동위원소 표지 과정.
(c) [U-13C]포도당을 주입한 환자의 시트르산 m+2/피루브산 m+3 비율.
(d) 환자별로 구분된 시트르산 m+2/피루브산 m+3 비율의 nested analysis 결과.
(e) TCA 회로 중간체의 총 동위원소 표지와 피루브산의 총 동위원소 표지 비율.
(f) 생체 모방 배양(organotypic cultures)의 모식도.
(g) [U-13C]포도당에서 얻은 환자 또는 조직 슬라이스의 총 시트르산 표지.
[Fig. 1a] 환자들이 신장암 수술 중에 13C로 표지된 영양소([U-13C]glucose)를 주입 받는 절차를 도식화한 그림입니다.
[Fig. 1b] [U-13C]glucose가 TCA 회로에 들어가며 피루브산 탈수소효소(pyruvate dehydrogenase; PDH)를 통해 대사되는 경로를 보여줍니다. 이는 피루브산(pyruvate)이 시트르산(citrate)으로 전환되는 과정에서 13C 표지화가 어떻게 이루어지는지를 설명합니다.
[Fig. 1c] [U-13C]glucose을 주입받은 환자들로부터 수집된 데이터로, ccRCC 샘플이 정상 신장 조직과 비교하여 시트르산/피루브산 비율이 낮다는 것을 보여줍니다. 이는 ccRCC에서 포도당이 PDH 반응을 통한 TCA 회로 내 반응에 적게 기여하고 있음을 나타냅니다. (높은 비율은 피루브산이 효율적으로 TCA 회로로 들어가고 있다는 것을 의미, ccRCC에서 포도당이 PDH를 통해 TCA 회로에 들어가는 과정이 억제되었음을 의미)
[Fig. 1d] 각 환자의 ccRCC와 인접한 정상 신장 조직을 비교한 결과, 17명의 환자에서 암 조직의 시트르산 m+2/피루브산 m+3 비율이 정상 조직보다 낮았음을 나타냅니다. 이는 암 조직에서 포도당 대사가 TCA 회로에 덜 기여한다는 것을 의미합니다.
[Fig. 1e] 에서는 전체 TCA 회로 중간체들이 정상 신장 조직에 비해 전반적으로 13C 표지가 감소하였음을 보여줍니다. 이는 포도당이 TCA 회로에 미치는 영향이 전반적으로 감소한 것을 의미합니다.
[Fig. 1f] 생체 외 배양 조직에서의 표지 실험 모식도입니다. 신장 또는 ccRCC 조직을 생체 외 배양하여 [U-13C]glucose를 통해 대사 과정을 연구하는 방법을 설명하는 모식도입니다.
[Fig. 1g] 환자의 실제 조직과 생체 외 배양된 ccRCC 조직 모두에서 시트르산의 13C 표지가 유사하게 억제되었음을 보여줍니다. 이는 이 대사 억제가 조직 자체의 특성임을 시사합니다.
Acetate and glutamine feed the TCA cycle
TCA cycle 내에서의 대사 과정을 보다 심층적으로 알아보기 위해, 앞서 glucose 위주로 진행한 연구를 acetate 및 glutamine과 같은 중간 물질로 대체하여 진행합니다.
![[Fig2] Mitochondrial complex I promotes kidney cancer metastatis](https://scienceeasyview.com/wp-content/uploads/2024/08/Fig2-Mitochondrial-complex-I-promotes-kidney-cancer-metastatis.png)
[Figure 2] ccRCC는 억제된 TCA cycle 대사를 보인다.
(a) [1,2-13C]아세트산이 TCA 회로에 들어가는 동위원소 표지 과정의 모식도.
(b) [U-13C]포도당 (G) 또는 [1,2-13C]아세트산 (A) 주입 후 정상 신장 및 ccRCC에서 측정된 Acetyl-CoA 농도.
(c) 정상 신장과 ccRCC에서 m+2 Acetyl-CoA의 표지 비율 비교.
(d) [1,2-13C]아세트산을 주입한 환자의 TCA 회로 중간체(m+2 시트르산, 푸마르산, 말산, 숙신산) 표지 수준 비교.
(e) [1,2-13C]아세트산 주입 후 TCA 회로 중간체들의 총 표지 수준 비교.
(f) [1,2-13C]아세틸-CoA가 두 번의 TCA 회로를 도는 동안 나타나는 13C 표지 경로.
(g) 정상 신장과 ccRCC에서 시트르산 m+4/시트르산 m+2 비율 비교.
(h) 정상 신장 및 ccRCC에서 분리한 미토콘드리아의 시트르산 m+4/시트르산 m+2 및 시트르산 m+2/피루브산 m+3 비율 비교.
(i) [1,2-13C]아세트산 주입 후 정상 신장과 ccRCC에서 [4,5-13C]글루타메이트가 총 글루타메이트 표지에서 차지하는 비율 비교.
[Fig. 2a] [1,2-13C]아세트산이 아세틸-CoA로 전환되어 TCA 회로에 진입하는 경로를 설명합니다. 이 cycle에 들어가기 위해 아세트산은 오직 아세틸-CoA로 변환되는 방법뿐이며, PDH 경로와 독립적으로 TCA 회로를 탐구하는 방법을 제공합니다.
[Fig. 2b] [U-13C]포도당 또는 [1,2-13C]아세트산을 주입한 후 ccRCC와 정상 신장 세포에서 아세틸-CoA 농도는 비슷하게 유지됩니다.
[Fig. 2c] ccRCC와 정상 신장 조직에서 m+2 아세틸-CoA의 동위원소 농도 비율이 비슷하게 나타나, 아세트산이 두 조직에 유사한 영향을 미쳤음을 보여줍니다. [Fig. 2b]의 설명과 함께 보았을 때, 동위원소 [1,2-13C]아세트산의 주입이 Acetyl-CoA 합성 과정에 큰 영향을 끼치지 않는다는 것을 의미하며, [1,2-13C]아세트산이 PDH 경로를 우회하여 TCA cycle에 진입하는 경로는 정상 작동한다는 것을 의미합니다.
[Fig. 2d] ccRCC와 정상 신장에서 TCA 회로 중간체의 m+2 표지 비율은 비슷하나, 첫 번째 TCA 회로 턴 이후 대사체의 총 표지 수준은 ccRCC에서 감소합니다. 중간체들의 유의한 차이는 아직 포착되지 않지만, 대사 시작 물질인 아세트산을 제외하고는 전반적으로 감소한 양상을 볼 수 있습니다.
[Fig. 2e] 위의 TCA 회로를 여러 턴 진행한 결과를 보여줍니다. TCA 회로 중간체들의 총 표지 수준은 ccRCC에서 감소하여, TCA 회로가 첫 번째 턴 이후 제대로 진행되지 않음을 시사합니다.
[Fig. 2f] 위 2(d) 및 2(e)에서 본 것처럼 TCA cycle의 반복 과정을 좀 더 깊게 탐구합니다. 우선 아세틸-CoA m+2가 TCA 회로를 두 번 돈 후 시트르산 m+4/시트르산 m+2 비율이 ccRCC에서 약 50% 감소한 것을 확인했습니다.
[Fig. 2g] ccRCC와 정상 신장에서 시트르산 m+4/시트르산 m+2 비율(TCA cycle을 두 번 거친 시트르산/한 번 거친 시트르산의 비율을 의미함)이 현저히 감소하여, TCA 회로의 2차 턴이 ccRCC에서 제대로 작동하지 않음을 나타냅니다. 이는 암 조직이 정상 신장 조직에 비해 TCA cycle의 빈도가 낮음을 의미합니다.
[Fig. 2h] ccRCC와 정상 신장 조직에서 분리한 미토콘드리아의 시트르산 m+2/피루브산 m+3 및 시트르산 m+4/시트르산 m+2 비율이 ccRCC에서 낮게 나타나, 미토콘드리아의 기능 장애가 존재함을 보여줍니다.
[Fig. 2i] 글루타메이트 m+2가 ccRCC와 정상 신장에서 비슷하게 나타나지만, TCA 회로 첫 번째 턴에서 형성된 글루타메이트의 비율이 ccRCC에서 더 높아, 다중 회전(TCA 회로를 여러 번 도는 과정)이 ccRCC에서 억제되고 있음을 보여줍니다.
![[Fig3-1] Mitochondrial complex I promotes kidney cancer metastatis](https://scienceeasyview.com/wp-content/uploads/2024/08/Fig3-1-Mitochondrial-complex-I-promotes-kidney-cancer-metastatis.png)
[Figure 3-1] ccRCC 미토콘드리아는 낮은 산화적 대사 기능을 가진다.
(a): [U-13C]글루타민에서 유래한 동위원소 표지가 산화 대사(회색)와 환원 대사(빨간색)로 구분되어 TCA 회로에 어떻게 진입하는지를 설명하는 모식도.
(b): [U-13C]글루타민 대사가 첫 번째 산화적 TCA 회로 턴을 통해 생성된 중간체 동위원소들의 변화를 보여주는 그래프.
(c): [U-13C]글루타민 주입 후 ccRCC 환자와 정상 신장 조직에서 TCA 회로 중간체들의 총 표지 수준을 비교한 그래프.
(d): 정상 신장 조직과 ccRCC에서 m+5 시트르산의 부분적 농축(표지) 비율을 비교한 그래프.
(e): 정상 신장 조직과 ccRCC에서 m+3 말산의 부분적 농축(표지) 비율을 비교한 그래프.
[Fig. 3a] [U-13C]글루타민 표지를 통해 TCA 회로에서 글루타민이 산화적(회색) 및 환원적(빨간색) 경로로 대사되는 과정을 시각화합니다. 이 때 글루타민은 암세포의 환원적 대사에 주로 사용되는 요소로 잘 알려저 있어, 현 연구에서도 이러한 점을 활용합니다.
[Fig. 3b] 암 조직(ccRCC)과 정상 신장 조직에서 m+5 글루타민과 TCA 회로 중간체들의 첫 번째 산화적 TCA 회로 턴에서의 m+4 표지 비율이 유사하게 나타났습니다.
[Fig. 3c] 암 조직과 정상 신장에서 TCA 회로 중간체들의 총 표지 수준은 유사했지만, 시트르산의 총 표지 수준은 암 조직에서 더 높게 나타났습니다. [Fig. 3b]의 결과와 함께 보았을 때, 산화적 TCA 회로의 대사는 두 조직이 크게 차이가 없음에도 불구하고 시트르산의 표지 수준이 높다는 것을 확인할 수 있습니다. 이는 산화적 사이클 이외의 방법을 통해 추가적인 시트르산 생성이 발생했음을 시사합니다.
[Fig. 3d] 암 조직에서 시트르산 m+5의 높은 비율이 관찰되었으며, 이는 환원적 경로가 더 많이 활성화된 것을 나타냅니다.
[Fig. 3e] 암 조직에서 m+3 말산의 높은 비율이 관찰되어, 환원적 경로를 통한 대사가 진행되고 있음을 보여줍니다.
Most kidney cancers have low respiration
앞서 논의된 부분에서는 주로 TCA 회로의 순환과 환원적 대사(reductive metabolism)에 초점을 맞췄습니다. 글루타민과 포도당이 어떻게 암세포에서 대사되고, 표지된 대사체들이 어떻게 분포되는지를 연구하여 암세포의 대사 상태를 파악하려고 했습니다.
이때, TCA 회로 회전률의 저하나 환원적 대사 증가가 발견되었고, 이는 암세포에서 전자전달계(ETC) 기능 장애가 있을 가능성을 시사했습니다. 이러한 이유로 효소 단위에서의 활동 차이를 관찰하여 TCA 회로 상에서 보이는 현상을 설명하고자 했습니다.
![[Fig3-2] Mitochondrial complex I promotes kidney cancer metastatis](https://scienceeasyview.com/wp-content/uploads/2024/08/Fig3-2-Mitochondrial-complex-I-promotes-kidney-cancer-metastatis.png)
[Figure 3-2] ccRCC 미토콘드리아는 낮은 산화적 대사 기능을 가진다.
(f): 정상 신장, ccRCC, 그리고 다른 신장암 아형의 미토콘드리아에서 ADP로 자극된 상태 III 산소 소비율(OCRs)을 비교한 그래프.
(g): ccRCC 미토콘드리아와 정상 신장 미토콘드리아에서 산소 소비율을 환자별로 정규화한 비교 그래프.
[Fig. 3f] ccRCC와 정상 신장 조직에서 분리한 미토콘드리아의 산소 소비율(OCR)을 측정한 결과, ccRCC 미토콘드리아는 정상 신장 미토콘드리아에 비해 복합체 I, II, IV에서 state III와 state IV의 호흡 활동이 모두 감소한 것으로 나타났습니다. 미토콘드리아의 전반적인 ATP 생성 능력 및 기저 호흡 활동을 평가하기 위해 state III 및 state IV를 비교하여 에너지 생성 능력을 평가했습니다.
[Fig. 3g] 환자별로 ccRCC 미토콘드리아의 산소 소비율(OCR)을 동일 환자의 정상 신장 미토콘드리아와 비교한 결과, 암 조직에서 분리된 미토콘드리아의 복합체 I, II, IV 산소 소비율이 항상 더 낮게 측정되었습니다.
Metastases increase TCA cycle labelling & Efficient metastasis requires complex I
![[Fig4] Mitochondrial complex I promotes kidney cancer metastatis](https://scienceeasyview.com/wp-content/uploads/2024/08/Fig4-Mitochondrial-complex-I-promotes-kidney-cancer-metastatis.png)
[Figure 4] Complex I은 쥐의 효율적인 암 전이를 위해 필요하다.
(a): [U-13C]포도당을 주입한 환자에서 시트르산 m+2/피루브산 m+3 비율 비교, 다양한 기관으로 전이된 ccRCC는 갈색으로 표시됨. 주요 ccRCC와 전이된 암 사이의 대사 차이를 나타냄.
(b): VHL−/− 세포를 신장 피막에 주입한 후, 21일 동안 차량 또는 IACS-010759로 처리한 원발성 종양.
(c): VHL−/− 세포를 신장 피막에 주입한 후, 21일 동안 차량 또는 IACS-010759로 처리한 폐 전이 결절.
(d): Methigh 또는 Metlow 세포의 증식을 위해 필수적인 복합체 I 유전자에 대한 BAGEL 점수.
(e): Methigh 및 Metlow 세포에서의 유전자 온톨로지 강화 비율, 적색 막대는 전자전달계(ETC) 관련 유전자.
(f): 차량 또는 IACS-010759로 21일간 처리한 원발성 종양 크기의 변화.
(g): 차량 또는 IACS-010759로 21일간 처리한 폐 전이 결절 크기의 변화.
(h): 빈 벡터(EV) 또는 NDI1을 발현한 Methigh 또는 Metlow 세포에서 원발성 종양의 크기 비교.
(i): 빈 벡터(EV) 또는 NDI1을 발현한 Methigh 또는 Metlow 세포에서 폐 전이 결절 크기의 변화.
(j): 빈 벡터 또는 NDI1을 발현한 Metlow 전이 결절이 있는 폐의 대표 이미지.
(k): 빈 벡터, 미토콘드리아-LbNOX 또는 세포질-LbNOX를 발현한 Methigh 또는 Metlow 세포에서 원발성 종양 크기의 변화.
(l): 빈 벡터, 미토콘드리아-LbNOX 또는 세포질-LbNOX를 발현한 Methigh 또는 Metlow 세포에서 폐 전이 결절 크기의 변화
[Fig. 4a] 해당 실험은 전이가 진행 중인 환자를 대상으로 수행했습니다. [U-13C]포도당을 주입한 환자에서 전이된 ccRCC가 신장에서의 주요 ccRCC에 비해 더 높은 시트르산 m+2/피루브산 m+3 비율을 보였으며, 이는 전이된 암세포들이 TCA 회로에 더 많은 기여를 하고 있음을 시사합니다.
[Fig. 4b] 전이된 암세포에서 미토콘드리아 complex I의 역할을 조사하기 위해 (b,c)에 해당하는 실험을 설계했습니다. VhlKO;Setd2KO;4q9p21− 신장 종양 세포(신장암 모델)를 NU-Foxn1nu 마우스(T세포 결핍 마우스 모델)의 신장에 이식한 후 IACS-010759(complex I 억제제)로 처리했을 때, 신장 종양의 크기는 치료군과 대조군 간에 차이가 없었습니다.
[Fig. 4c] 같은 실험에서 IACS-010759가 두 세포주 모두에서 폐로 전이된 암세포 성장을 현저히 억제했음을 보여줍니다.
[Fig. 4d] Methigh (전이 능력 높음) 세포와 Metlow (전이 능력 낮음) 세포에서 complex I 유전자 관련 CRISPR screen 결과가 제시되었으며, Methigh 세포는 complex I 의존성이 더 큽니다.
[Fig. 4e] Methigh 및 Metlow 세포의 gene ontology 분석에서, Methigh 세포에서 전자전달계(ETC) 관련 유전자 세트가 중요한 역할을 하는 것으로 나타났습니다.
[Fig. 4f] 위에서 비교한 두 종류의 세포주를 신장에 이식한 실험입니다. Methigh 및 Metlow 세포주를 사용한 신장 종양 모델에서, IACS-010759로 처리해도 신장 종양 크기에는 차이가 없었습니다.
[Fig. 4g] 같은 실험에서 Methigh 세포의 폐 전이가 IACS-010759 처리로 억제되었으며, Metlow 세포와 비슷한 수준으로 전이가 감소했습니다.
[Fig. 4h] Metlow 세포에서 호흡 작용이 덜 발생하는 것을 통해, ETC를 활성화시켰을 때 전이능력에영향을 주는지에 대해 의문을 가질 수 있게 되었습니다. Methigh 및 Metlow 세포에 NDI1을 발현시켰을 때 신장 종양의 크기에는 변화가 없었습니다.
[Fig. 4i] NDI1을 발현한 Metlow 세포의 폐 전이가 Methigh 세포와 유사한 수준으로 증가했으며, NDI1이 Metlow 세포의 전이 능력을 높였음을 보여줍니다.
[Fig. 4j] Metlow 세포에 NDI1(NADH dehydrogenase)을 발현시킨 폐 전이 결절의 대표 이미지가 제시되었습니다.
[Fig. 4k] Mito-LbNOX(Lactobacillus brevis NADH oxidase) 또는 Cyto-LbNOX를 발현시킨 Metlow 세포를 사용한 신장 종양 모델에서 종양 크기에는 변화가 없었습니다.
[Fig. 4l] 같은 실험에서 Mito-LbNOX 및 Cyto-LbNOX를 발현한 Metlow 세포가 폐 전이 결절의 크기를 증가시켰습니다.
[Figure 5] 미토콘드리아 관련 유전자 발현의 증가는 human ccRCC로부터의 생존에 악영향을 미친다.
(a): OxPhos 점수(Oxidative Phosphorylation score)를 기준으로 grade 1/2 종양과 grade 3/4 종양 간 크기 비교.
(b): Kaplan-Meier 생존 곡선에서, OxPhos 점수에 따라 1, 2단계의 grade 3/4 종양 환자의 생존율 차이를 비교.
(c): 3, 4단계의 grade 3/4 종양 환자를 대상으로 OxPhos 점수에 따른 생존율을 비교했을 때, OxPhos 점수가 높은 환자들의 생존율이 더 낮았음.
(d): mtDNA 복사본 수에 따라 환자들을 구분한 Kaplan-Meier 생존 곡선에서, mtDNA가 높은 환자들의 생존율이 더 낮았음.
Disscussion
이 연구는 ccRCC(신장암)에서 [U-13C]포도당 주입 후, TCA 회로에 대한 포도당의 기여가 원발성 종양보다 전이성 종양에서 더 높다는 사실을 발견했습니다. 이는 전이 과정에서 암세포의 미토콘드리아 기능이 변화하거나 선택적으로 강화될 수 있음을 시사합니다. 연구는 또한 미토콘드리아 전자전달계(ETC)의 여러 요소가 손상되어 산화적 대사(OxPhos)가 억제된다는 점을 밝혔습니다.
다른 암종에서도 유사한 현상이 관찰되었으며, ETC 억제가 전이 억제에 효과적일 수 있다는 증거가 제시되었습니다. 예를 들어, 췌장암, 흑색종, 급성 골수성 백혈병 등에서 ETC 억제가 전이 및 재발을 막는 데 도움이 되었습니다. 이는 미토콘드리아 대사가 암의 진행에 중요한 역할을 한다는 점을 강조합니다.
마지막으로, 연구는 미토콘드리아 기능이 전이와 어떤 방식으로 연결되어 있는지를 이해하는 것이 중요하며, NAD+/NADH 균형이 전이를 지지하는 데 충분할 수 있음을 시사합니다. 그러나 ETC 기능이 전이에 미치는 다른 영향도 추가 연구가 필요합니다. 이를 기반으로 환자에게 부작용을 최소화하면서도 미토콘드리아 기능을 표적으로 하는 맞춤형 치료법 개발이 필요합니다.