In vivo 상호작용 screening은 전이에 대한 간 유래 constraints를 밝혀낸다
Abstract
전이된 암 세포 중 단 0.02%만이 *명확한 전이(overt metastasis)를 일으킬(seed) 수 있는 것으로 추정된다. 이는 전이의 seeding에 대한 환경적 제약이 존재함을 시사하지만, 이 과정을 제어하는 host factor의 구체적인 landscape는 여전히 명확하지 않다. 여기에서 우리는 transposon 기술과 fluorescence niche labelling을 결합하여 간세포와 전이 세포 간의 상호작용을 체계적으로 조사하기 위한 생체 내 CRISPR activation screen을 개발했다. 우리는 대장암, 췌장암 및 흑색종 동종 마우스 모델에서 간 colonization의 중요한 숙주 유래 조절자로서 plexin B2를 확인했다. 우리는 plexin B2가 종양 세포의 IV형 semaphorin과 상호작용하여 KLF4의 상향 조절을 유도하고, 그 결과 상피 특성의 획득을 촉진하는 메커니즘을 분석했다. 우리의 결과는 증식 촉진 niche가 형성되기 전 종양 세포의 전이 seeding에 대한 간 실질(parenchyma) 유래 신호의 필수적인 역할을 강조한다. 또한, 우리의 연구는 CRC 전이 과정에서 새로운 조직 환경에 적응하는 데 상피화(epithelialization)가 필요함을 시사한다. plexin-B2-semaphorins 축을 차단하면 간 전이 과정에서의 colonization이 중단되므로, 간 전이 예방을 위한 치료 전략을 제시한다. 마지막으로, 우리의 screening 접근 방식(종양 자체의 내인성 요인보다 전이 seeding을 촉진하는 능력을 가진 host-derived 외인성 신호를 평가)은 널리 적용 가능하며, 다른 장기 및 암 유형에서 전이의 환경적 제약을 screening하기 위한 프레임워크를 제공한다.
* 명확한 전이(overt metastasis): 임상 증상, 영상 검사, 조직학적 확인 등 명확히 감지 가능한 전이 상태
Figures
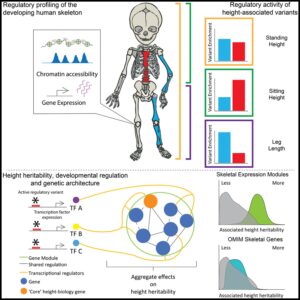
Screening interactions in a mosaic liver
– Mosaic liver를 활용하여 전이 근처 및 원거리에 위치한 간 세포에서 과발현되는 유전자를 식별함으로써 암 전이를 촉진 또는 억제하는 요인을 식별. 주화성 인자 (chemoattractants) 및 축삭 유도 분자 등이 전이 촉진 인자로 식별됨.
– 암세포 및 특정 유전자를 과발현하는 간 세포를 공동 배양하는 실험과 실제 재조합 단백질을 첨가하는 실험을 통해 축삭 유도 분자의 일종인 plexin B2가 암세포 성장에 기여하는 인자로 식별됨. 주화성 인자들은 해당 실험에서 암세포 성장에 기여하지 못함.

Fig. 1. Mosaic liver에서 암-간 세포 사이의 상호작용 Screening
(A) Screen 과정의 개요도. *DTCs는 seeding 촉진 또는 seeding 억제 변동성을 가진 간세포와 상호작용하며, 이 상호작용은 국소 전이성 성장(local metastatic outgrowth)에 영향을 미치고, 따라서 전이 근처 간세포에서 **sgRNA의 농도를 증가시킴.
(B) 근접 농축 점수(proximal enrichment score)에 따라 순위가 매겨진 유전자들. seeding 촉진 인자는 GFP+mCherry+ 간세포(빨간색)에, 억제 인자는 GFP+mCherry- 간세포(녹색)에 농축됨. 상위 점수를 받은 ***SRFs는 오른쪽에 나열.
(C) 억제 인자 두 개 및 촉진 인자 두 개에 대한 개별 sgRNAs의 log-transformed fold change(FC)를 모든 마우스(n=7) 및 라이브러리 배치(n=3)에 대해 표시.
(D) SRFs의 GSEA 결과. 점의 크기는 유전자 세트 크기를 나타냄.
(E) 인간 CRC 간 전이에서의 상호작용 분석. 전이 근처 간세포(오렌지색)에서 발현된 SRFs가 종양 세포의 전이 leading edge에서 22개의 LRs (Ligands and Receptors)와 상호작용할 것으로 예측됨.
(F) 간 전이에서 자주 돌연변이가 발생하는 LRs와 SRFs 간의 예측된 상호작용. 오렌지색(Copy Number Variation, CNV – 증폭), 노란색(돌연변이) 또는 파란색(삭제)으로 표시.
(G) Alb-cre;dCas9-SPH 간세포(GFP+)와 AKPSsLP-mCherry colonies(mCherry+, 화살표) 공동 배양을 보여주는 대표적인 형광 현미경 사진.
(H) SRFs를 과발현하는 AML12dCas9-SPH 세포와 공동 배양된 AKPSsLP-mCherry organoids의 CFU.
(I) Plxnb2를 과발현하는 AML12 세포와 공동 배양된 AKPSsLP-mCherry organoids의 CFU(well당) (n=10 wells).
(J) rmPlexin B2로 처리된 AKPSsLP-mCherry organoids의 CFU.
(K) rhPlexin B2로 처리된 PDOs(Patient-Derived Organoids)의 CFU.
* DTCs (Disseminated Tumor Cells): 원발성 종양에서 떨어져 나와 몸의 다른 부위로 퍼져 전이를 일으킬 수 있는 암세포.
** sgRNA (Single-guide RNA): CRISPR-Cas9 시스템에서 특정 유전체 위치로 안내하여 유전자 편집을 수행하도록 설계된 합성 RNA 분자.
*** SRFs (Seeding-Regulating Factors): 새로운 장기 환경에서 전이성 종양 세포의 초기 seeding, 생존 및 성장을 조절하는 유전적 또는 분자적 요인.
[Fig 1A] CRISPR-a 시스템으로 간 세포에 수백 개의 유전자를 랜덤하게 과발현시킨 모자이크 간(Mosaic liver)를 만들고, 전이성 종양 세포가 성공적으로 전이를 이뤄내는 지역과 반대 지역에서의 cell들을 비교함으로써 seeding을 촉진 또는 억제하는 요소를 식별함.
[Fig 1B, C] mCherry는 삽입된 전이성 종양세포로, mCherry의 존재 여부로 전이가 실제로 이뤄진 지역 근처와 원거리에 위치한 간 세포를 구분 가능. 즉, mCherry+ 지역에서 발현된 유전자는 전이 촉진, mCherry- 지역에서 발현된 유전자는 전이 억제로 취급할 수 있음(Fig 1B). 두 지역에서 가장 차이가 많았던 촉진, 억제 관련 인자 각 2개는 여러 마우스 및 라이브러리 배치에서 일관된 경향을 보임(Fig 1C).
[Fig 1D] 전이에서 멀리 떨어진 지역에서 급성기 반응 (Acute phase response, APR) 관련 유전자가 과발현되었으며, 이들의 상향 조절은 국소면역 활성화로 전이성 종양세포의 정착을 방해할 수 있음을 시사함. 전이 근처에서는 상피성장인자, 축삭 유도 관련 유전자들이 과발현되었으며, 신경 관련 성장인자의 과발현은 전이성 종양세포가 축삭 형성 pathway를 hijacking하여 내피세포와 상호작용한다는 기존 연구결과와 일치함.
[Fig 1E] SRFs에 의해 실제 반응이 일어나기 위해 LRs에 의한 신호 전달 과정이 작용할 수 있으며, 주화성 인자 (chemoattractants) 및 축삭 유도 분자 LRs가 SRFs와 상관관계를 가짐.
[Fig 1F] published dataset에서 매칭된 원발성 종양과 비교해 간 전이에서 차등적으로 발현된 유전자 변이 중 LRs들을 추출하고, 간 세포에서 발현된 그들의 상호작용 대상을 확인. 간 전이 암에서 차등적으로 이뤄진 LR 관련 돌연변이 중 주로 deletion은 억제, amplification은 촉진과 상호작용하는 것으로 예측.
[Fig 1G] 간 세포와 암세포를 공동 배양하여 SRFs가 암 성장에 미치는 상호작용을 직접 테스트.
[Fig 1H,I] 공동배양 결과 여러 후보군 중 간 세포에서 Plxnb2, Psen1 및 Gprc5b의 과발현은 암 세포의 성장에 강력한 효과를 보임.
[Fig 1J,K] 마우스 암세포에 마우스 재조합 plexin B2 단백질의 외측 도메인(rmPlexin B2)을 인위적으로 첨가하거나, 환자 유래 결장암 organoids에 인간 재조합 plexin B2(rhPlexin B2)를 첨가해도 암세포가 성장함.
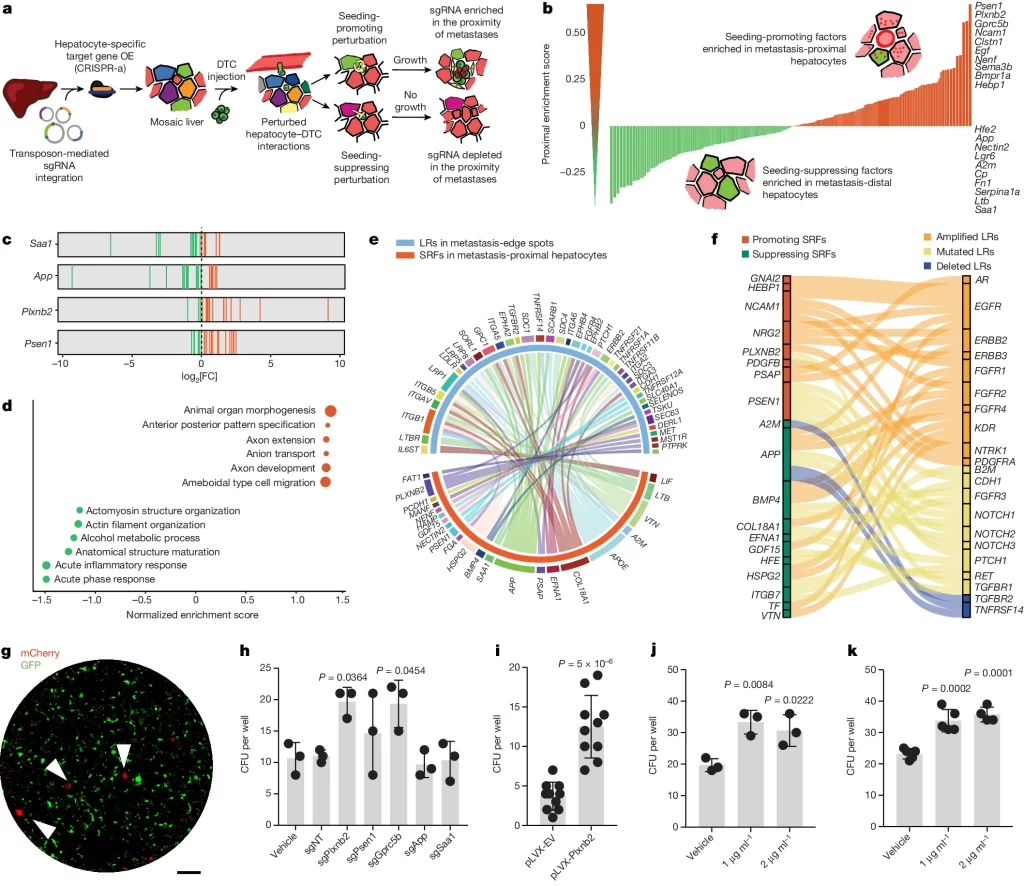
Plexin B2 is required for liver seeding
– 다양한 암세포를 대조군, Plxnb2-KO, Plxnb2-OE 마우스에 투입해 각각 plexin B2가 일반 수준으로 존재할 때, 존재하지 않을 때, 과도하게 존재할 때 간에서의 암 전이가 이뤄지는 정도를 확인.
– Metastatic foci의 수, 암세포의 수 등을 확인했을 때 Plxnb2가 더 많이 존재할수록 전이가 촉진됨. 병변 확인 결과에서도 Plxnb2가 과발현됐을 때 전이의 상피성이 증가했으며, 발현 억제 시에는 병변의 수와 상피성 모두 감소함.
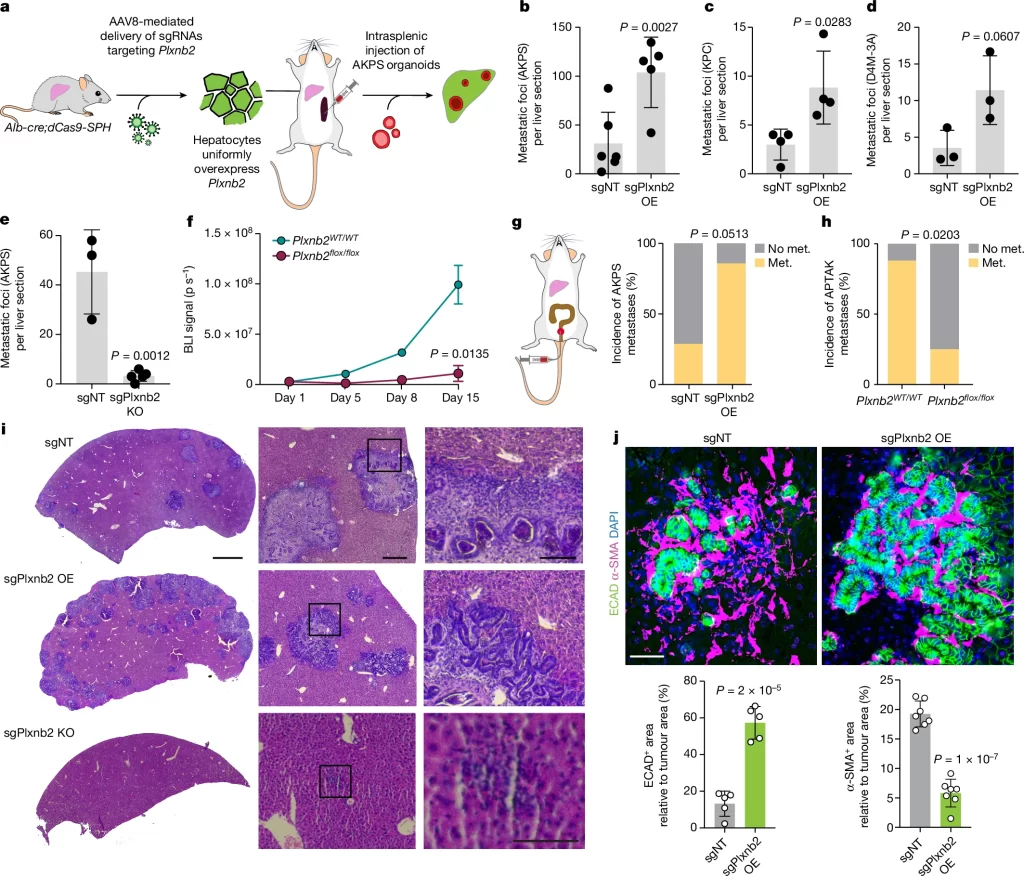
Fig. 2. 간세포 유래 plexin B2는 간 colonization에 필요함
(A) AAV8-U6-sgPlxnb2OE-EF1a-eGFP 주입은 간세포에서 dCas9-SPH 매개 Plxnb2 과발현(OE)을 유도하고, 이어서 AKPS organoids를 비장 내 주입함.
(B-D) 서로 다른 종류의 암 세포를 Plxnb2-OE 및 대조군 마우스에 주사한 후 간 단면에서의 *Metastatic foci의 수를 비교한 결과. (B) AKPS organoids를 주입 (Plxnb2-OE, 대조군 각각 n=5, n=6), (C) KPC 세포를 주입 (Plxnb2-OE, 대조군 각각 n=4), (D) D4M-3A 세포를 주입 (Plxnb2-OE, 대조군 각각 n=3)
(E) Plxnb2 KO (n=4) 또는 대조군 (n=3) 마우스에 AKPS organoids를 주입한 후 2주 후 간 단면당 Metastatic foci.
(F) AAV8-Alb-cre-moxGFP와 그 후 AKPSluciferase;zsGreen organoids를 주입받은 Plxnb2flox/flox (n=3) 또는 Plxnb2WT/WT (n=4) 마우스에서 시간에 따른 ** BLI 신호.
(G,H) 자발적인 간 전이 발생률을 (G) 1차 종양이 AKPS일 때 두 마우스 그룹(Plxnb2-OE 마우스, 대조군 마우스)에 대해 비교(그룹당 n=7)한 결과, (H) 1차 종양이 APTAK인 두 마우스 그룹 (Plxnb2-KO 마우스, 대조군)에 대해 비교(그룹당 n=7)한 결과.
(I) Plxnb2-OE, Plxnb2-KO 및 대조군 간에서 AKPS 전이를 나타내는 대표적인 H&E 염색.
(J) Plxnb2-OE 및 대조군 간에서 AKPS 전이의 α-SMA (마젠타) 및 ECAD (녹색) 면역반응성을 나타내는 대표적인 형광 현미경 사진 및 정량화. DAPI (핵 대조 염색)는 파란색 표시. 정량화는 종양 영역을 나타내며, 각 점은 그룹당 2마리의 마우스에서 통합된 개별 간 전이를 나타냄.
* Metastatic foci: 종양이 원발 부위에서 떨어져 나와 다른 장기나 조직으로 전이된 후 형성된 작은 종양 집합체.
** BLI (Bioluminescence Imaging): 생체 내에서 발광 단백질(e.g. Luciferase)을 이용하여 생물학적 과정을 실시간으로 시각화하고 모니터링하는 기술.
[Fig 2A,B] Plxnb2 과발현(OE) 마우스에서 AKPS organoids 주사 시 metastatic foci 증가량은 대조군 대비 3배에 달함.
[Fig 2C,D] Plxnb2 과발현은 다른 종류의 암종 seeding도 촉진함.
[Fig 2E,F] Plxnb2 KO mouse에서 AKPS organoids 주입에 따른 Metastatic foci를 확인하거나, luciferase 발현으로 암세포의 성장을 확인했을 때 전이성 성장이 거의 완전히 방지됨.
[Fig 2G,H] Plexnb2 과발현 마우스는 더 높은 비율의 자발적인 간 전이를 발생시켰고, 반대로 Plexnb2 제거 마우스는 전이 잠재력이 높은 APTAK organoids의 자발적인 간 전이 발생을 감소시킴.
[Fig 2I, J] 조직학적 분석 및 형광 분석 결과 Plxnb2 과발현 및 Knockout에 따른 변화를 관찰함. Plxnb2 Knockout 시 몇 안 되는 병변이 남아있고 세포 배열이 혼란하며 종종 선(gland) 구조가 부족하여 상피 형성이 저해된 것으로 보임. 반면, Plxnb2 과발현(OE) 마우스의 간 병변은 주로 상피 세포로 구성되어 대조군에서 주로 간 전이를 둘러싸고 있는 α-평활근 Actin(α-SMA) 및 Periostin(POSTN) 양성 섬유아세포가 적으며, 광범위한 CD146+ 혈관 네트워크를 보임.
Plexin B2 induces epithelialization
– plexin B2가 간 colonization을 제어하는 메커니즘 scRNA-seq, scATAC-seq, 면역형광염색법 등을 사용해 확인.
– AKPS organoids에 plexin B2를 처리한 후 scRNA-seq 데이터를 분석한 결과 암 세포 증식 유도가 관찰됨. 이와 일치하게, Plexnb2-OE 마우스의 병변에서는 상피세포의 증식이 증가하고 조직화된 구조를 형성하는 증거들을 발견함.
Fig. 3. plexin B2는 간 전이에서 epithelialization을 유도함
(A) rmPlexin B2로 처리한 AKPS organoids의 UMAP 분석. 점들은 개별 세포를 나타내며, rmPlexin B2의 처리 여부 (좌측 상단, 처리군-녹색, 대조군-회색) 또는 전사 클러스터(중앙 하단, 그룹별로 황색, 녹색, 청색)에 따라 색상을 가짐. 전사 클러스터에 따른 분류에 대해 클러스터 0과 1에 대해 유의하게 풍부한 유전자 온톨로지(GO) (중앙 하단), 처리 집단별 전사 클러스터 구성(우측 상단).
(B) Plxnb2-OE 및 대조군 간에서 AKPS 전이의 ECAD(녹색) 및 Ki-67(마젠타) 면역반응성을 나타내는 대표적인 형광 현미경 사진 및 정량화. DAPI(핵 대조 염색)는 파란색으로 표시. 각 점은 각 그룹당 두 마우스에서 모인 개별 간 전이(n=5).
(C) Plxnb2-OE 및 대조군 간에서 종양 세포의 UMAP 분석(RNA profile). 각 점은 조건에 따라 색상이 지정된 단일 핵을 표시.
(D) Plxnb2-OE와 대조군 간에서 종양 세포의 GSEA 분석.
(E) Plxnb2-OE 및 대조군 간에서 AKPS 전이의 F-actin을 나타내는 대표적인 형광 현미경 사진 및 정량화. 각 점은 각 그룹당 두 마우스에서 모인 *전이성 선 구조(metastatic glands)의 apical F-actin segments를 나타냄(n=18).
(F) Plxnb2-OE 및 대조군 간에서 종양 세포의 UMAP 분석(ATAC profile). 점들은 조건에 따라 색상이 지정된 단일 핵을 표시.
(G) Plxnb2-OE와 대조군 간에서 종양 세포의 차별적인 accessible 피크에서 풍부한 전사 인자 결합 모티프.
(H,I) Plxnb2-OE, Plxnb2-KO 및 대조군 간에서 AKPS 전이의 (H) KLF4 또는 (I) ZEB1(빨강) 및 ECAD(회색)의 면역반응성을 나타내는 대표적인 형광 현미경 사진 및 정량화. DAPI(핵 대조 염색)는 파란색으로 표시. 별표는 배경을, 각 점은 각 조건의 마우스들(n=3)에서 모인 전이에서 개별 핵을 표시.
*전이성 선 구조(metastatic glands): 전이된 암세포가 새로운 부위에서 형성한 선(gland) 구조로, 상피세포의 특징을 나타냄.
[Fig 3A] scRNA-seq 결과 AKPS organoids에서 rmPlexin B2로 2시간 처리했을 때 MAPK 및 JNK 신호 전달, 세포 접합 조립 및 형태 형성 관련 유전자 세트 발현이 높은 세포의 비율이 증가함.
[Fig 3B] Plxnb2-OE 마우스의 간 병변은 높은 밀도의 Ki-67+ 상피 세포를 포함하여 in vivo에서 향상된 성장을 보이며, 낮은 수준의 cleaved caspase 3을 포함함.
[Fig 3C,D] 유전자 세트 풍부도 분석(GSEA) 결과 Plxnb2-OE 마우스의 암 세포에서 세포 분열, 형태 형성 및 세포 돌기의 조립과 관련된 유전자 세트들의 상향 조절 및 면역 관련 유전자 세트의 하향 조절을 확인.
[Fig 3E] 세포 골격 재구성과 일치하게, phalloidin 염색은 Plxnb2-OE 간의 AKPS 간 전이 metastatic glands 구조에서 주목할 만한 apical F-actin 축적을 나타냄. 이는 세포의 극성 (polarity)를 통한 조직적인 구조 형성과 cell adhesion 등에 기여함.
[Fig 3F] 전이에서 plexin B2의 효과를 매개하는 전사 인자를 밝히기 위해 종양 세포의 chromatin profile을 사용하여 차별적으로 accessible한 motif를 확인.
[Fig 3G-I] 세포 생존 및 상피성 억제와 관련된 전사인자들이 plexin B2의 효과를 매개할 수 있음을 확인. 대조군과 비교하여 (G) Plxnb2-OE 간에서 성장하는 전이는 zinc-finger 전사 인자 중 세포 생존과 연관된 SP/KLF family, (H) 그 중 KLF4가 특이적으로 발현됐고, 반면, (I) 상피성을 억제하는 인자인 ZEB1 발현의 경우 Plxnb2-KO 마우스에서만 특이적으로 발현됨을 확인.
Plexin B2 interacts with class IV semaphorins
– plexin B2가 암 세포의 어떤 요소와 상호작용하는지 확인하기 위해 항체를 통한 semaphorin과의 결합 억제 실험, semaphorin Knockout 및 Knockdown된 AKPS organoids와 대조군 organoids의 공동 접종 실험 등을 진행함.
– plexin B2는 semaphorin–KLF4 축을 통해 전이를 촉진하며, semaphorin 발현을 감소 또는 억제할 경우 전이 및 상피성이 억제됨.
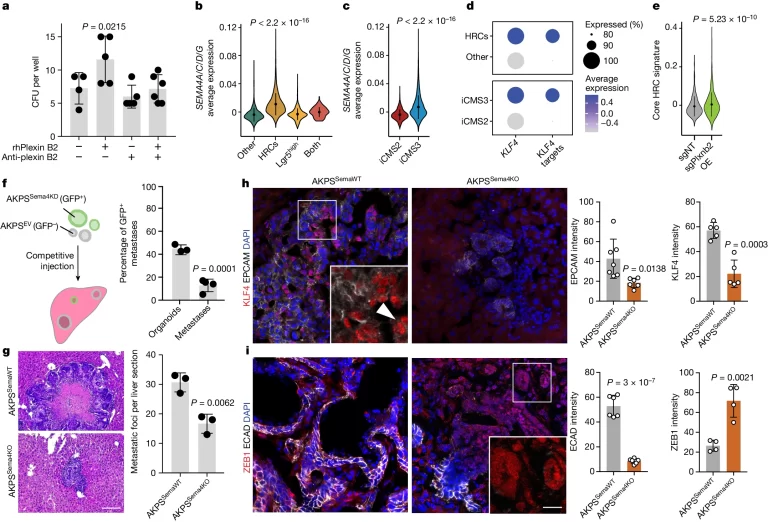
Fig. 4. plexin B2는 암 세포에서 semaphorins와 상호작용함
(A) rhPlexin B2(n=5), anti-Plexin B2 항체(n=5), 둘 다(n=6) 또는 IgG1 동형 대조군(n=4)과 함께 배양된 PDO의 well 당 CFU. 점은 개별 well을 나타냄.
(B, C) 1차 CRC(Samsung dataset; n=25)의 상피 세포에서 SEMA4A, SEMA4C, SEMA4D 및 SEMA4G의 평균 발현. 세포는 (B) HRCs, Lgr5high, 기타, 둘 다의 4가지 그룹 또는 (C) iCMS2 대 iCMS3 2가지 그룹으로 그룹화됨.
(D) 1차 CRC(Samsung dataset; n=25 환자)에서 HRCs 대 기타 세포 및 iCMS3 대 iCMS2 세포에서 KLF4 및 KLF4 타겟의 발현.
(E) Plxnb2-OE 대 대조군 간에서 AKPS 전이의 핵심 HRC signatures 발현. 데이터는 두 개의 독립 실험에서 통합되었으며, 각 조건당 n=2 마우스.
(F) (좌) 경쟁 seeding 실험의 개요도. EV는 빈 벡터를 의미. (우) 주입 2주 후 GFP+ 전이의 백분율 대 주입 혼합물에서 GFP+ organoids의 백분율. 점은 개별 마우스(각 그룹당 n=4)를 나타냄. 결과는 두 개의 독립 실험에서 통합.
(G) AKPSSemaWT 또는 AKPSSema4KO 전이의 대표적인 H&E 염색. (우) AKPSSemaWT 또는 AKPSSema4KO organoids를 비장 내 주입한 후 2주 후 간 단면당 전이. 점은 개별 마우스(각 그룹당 n=3)를 나타냄.
(H, I) AKPSSemaWT 및 AKPSSema4KO 전이에서 (H) EPCAM(회색) 및 KLF4(빨강) 또는 (I) ECAD(회색) 및 ZEB1(빨강) 면역반응성을 나타내는 대표적인 형광 현미경 사진 및 정량화. 점은 개별 전이당 평균 핵 신호를 나타내며(n=7 (EPCAM), n=5 (KLF4), n=6 (ECAD), n=4 (ZEB1)), 각 조건당 세 마우스에서 통합.
[Fig 4A] rhPlexin B2가 PDOs에서 seeding을 촉진하는 효과는 plexin B2의 semaphorin 결합 도메인을 차단하는 항체에 의해 억제됨. 즉, plexin B2의 전이 촉진 효과는 semaphorin과 연관성을 가짐.
[Fig 4B-D] 두 개의 인간 CRC scRNA-seq 데이터셋에서 semaphorin 유전자와 KLF4 타겟 유전자의 발현은 HRCs(high-relapse cells, 재발이 잦은 세포)와 iCMS3(intrinsic consensus molecular subtype 3, 대사 관련 유전자 발현을 특징으로 하는 암의 subtype) cells에서 유의하게 상향 조절되었으나, Lgr5high 세포에서는 그렇지 않았음.
[Fig 4E] Plxnb2-OE 간에서 자란 전이 세포, rmPlexin B2를 처리한 AKPS organoids에서 핵심 상피 HRC 시그니처가 유의하게 상향 조절.
[Fig 4F] 경쟁 seeding 실험에서 대조군 organoids와 함께 공동 주입하면, AKPSSema4KD organoids의 생체 내 이식 능력이 감소.
[Fig 4G] 간 colonization을 측정하기 위해 AKPSSema4KO organoids를 비장 내 주입했을 대 대조군에 비해 전이 부담이 유의하게 감소.
[Fig 4H,I] AKPSSema4KO 전이에서 KLF4 면역반응성이 사라졌고, 이는 감소된 EPCAM 및 ECAD 발현과 높은 ZEB1 수준을 추가로 나타냄.
Disscussion
전통적으로 암 진행의 말기 현상으로 여겨졌던 DTC의 확산은 최근 암 발생의 초기 현상으로 인식되고 있다. 최근 연구들은 순환 중인 DTC의 생존, DTC 휴면 상태 조절, 또는 재발 촉진 메커니즘을 밝혀냈다. 그러나 유출(extravasated)된 단일 종양 세포를 추적하는 기술적 어려움 때문에 DTC가 낯선 장기 환경에 적응하고 생존하는 데 필요한 환경적 요인은 여전히 대체로 불분명하다. 이러한 요인을 식별하면 전이가 가장 취약한 시점, 즉 성장 촉진 전이 niche가 형성되기 전에 전이를 목표로 하는 치료적 창을 밝혀낼 수 있을 것이다. 여기에서 제시된 결과는 1) 간세포 유래 plexin B2와 종양 세포의 class IV semaphorins 간의 상호작용이 KLF4 매개 간 전이에서 상피화(epithelialization)의 필수 유도자임을 확인하고, 2) 전이 seeding에 대한 이해를 심화하기 위한 방법론적 프레임워크를 제시한다.