생리학적 온도가 TRPM4 ligand 인식 및 개폐에 미치는 영향
Abstract
온도는 특히 온도 민감성을 가진 단백질에서 거대분자의 기능에 깊은 영향을 미칩니다. 그러나 비생리학적 온도에서 일반적으로 수행되는 생물물리학적 연구에서는 그 영향을 종종 간과하여 메커니즘 및 약리학적 통찰력에 부정확함을 초래할 수 있습니다.
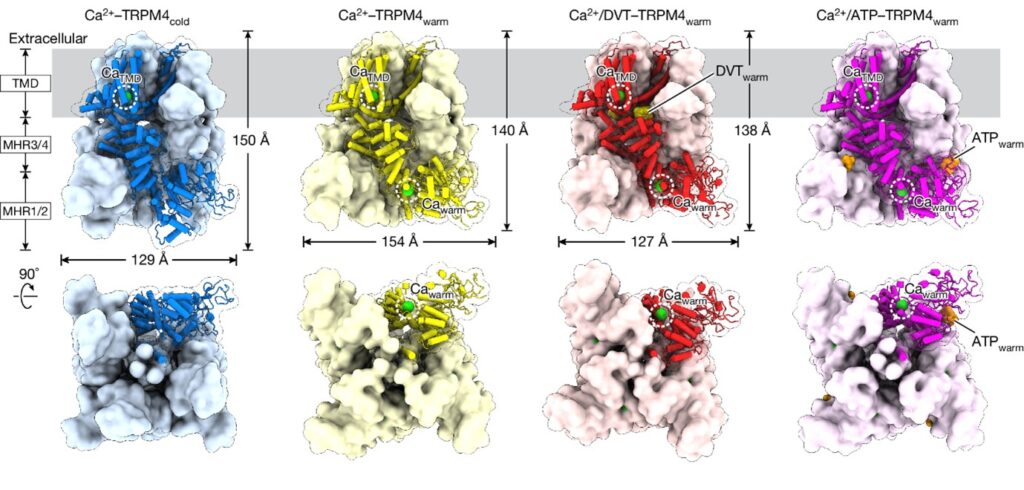
이 연구에서는 온도 민감한 Ca2+-활성화 이온 채널인 TRPM4의 구조와 기능에서 온도 의존적인 변화를 보여줍니다. single-particle cryo-electron microscopy를 사용하여 생리학적 온도에서 준비된 TRPM4를 연구함으로써, 낮은 온도에서 관찰된 것과는 다른 ‘warm’ 형태를 확인했습니다. 이 형태는 세포 내 도메인의 온도 의존적인 Ca2+ 결합 부위에 의해 형성되며, 생리학적 맥락에서 TRPM4 기능에 필수적입니다. 우리는 decavanadate (양성 조절제)와 ATP (억제제)로 예시된 ligand가 생리학적 온도에서 낮은 온도와 다른 위치에 TRPM4에 결합하며, 이러한 부위가 진정한 기능적 관련성을 가진다는 것을 입증했습니다. 우리는 생리학적 온도에서 TRPM4의 다양한 기능적 상태의 구조적 스냅샷을 포착함으로써 채널 개방 메커니즘을 설명했으며, 이는 낮은 온도에서는 관찰되지 않았습니다.
우리의 연구는 이온 채널의 온도 의존적 ligand 인식 및 조절의 예를 제공하며, 생리학적 온도에서 거대분자를 연구하는 것의 중요성을 강조합니다. 또한 열 민감성 TRPM 채널이 온도 변화를 인식하는 방법을 해독하는 잠재적인 분자적 틀을 제공합니다.