최초의 MKK4억제제는 간 재생을 향진 시키며 간 부전을 예방한다
Abstract
간 질환은 전 세계적으로 연간 200만 명 이상의 사망을 초래하는 대표적인 질환입니다. 급성 혹은 만성으로 손상된 간은 무한한 재생 잠재성을 가지고 있는 건강한 간과 달리 특정 간 미세 환경 의 손상으로 인해 간 세포 재생 능력이 약화된 변화가 발생합니다. 최근 우리는 간 세포 재생의 주요 조절자로 이중 특이성 키나제(Kinase) MKK4를 발견했습니다. MKK4는 MAP2 키나제이며, 스트레스 활성화 단백질 키나제(SAPK)/미토젠 활성화 단백질 키나제(MAPK) 신호 네트워크의 일부이며 세포가 다양한 스트레스 자극에 노출될 때 활성화됩니다. MKK4의 짧은 헤어핀 RNA(shRNA)에 의한 침묵은 MKK7 및 JNK1을 통해 SAPK 신호를 주로 재 활성화하여 ATF2 및 ELK1에 의한 하류 재생 전사 프로그램을 통해 급성 또는 만성 손상된 간의 내생적 재생 능력이 발견되었습니다. 그러나 MKK를 작은 분자 단위 억제자가 현재 발견되지 않았기에 우리는 이 연구를 통해 이중 특이성 키나제 MKK4를 억제하는 최초의 억제자(MKK4i)를 보고하고자 합니다. MKK4i는 쥐 및 돼지 모델에서 간 절제술 후 간 재생을 촉진했습니다. 놀랍게도, 임상 후보물질이자 MKK4 억제자인 HRX215로 인한 치료는 간절제술 후 간 부전을 예방하고 치명적인 85% 간 절제 모델에서 돼지의 생존을 가능하게 했습니다. 이는 HRX215에 의한 간 재생 촉진이 인간의 간 이식 후의 여러 증후군에 대한 치료 옵션으로 생각될 수 있다는 것을 시사하기에 48명의 건강한 자원봉사자를 대상으로 한 제1상 임상 시험을 실시하였습니다. 그 결과HRX215의 우수한 안전성, 내성 및 약동학(PK)이 확인되었습니다. 이 연구는 HRX215이 광범위한 종양학적 간 절제술 또는 소량 간이식 후 간 부전을 예방/치료하기 위한 옵션이 될 수 있도록 하는 추가적인 임상 시험 이 더 진행되어야 함을 시사합니다.
Figures
To mimic the systemic action of MKK4 inhibitors along with assessing tolerability and safety.
– MKK4의 기능을 억제 하였을 시의 상황을 관찰하고 장기간 이 기능의 억제가 생체의 생존과 안전성에 어떤 영향을 미치는지 보고자 하였다.
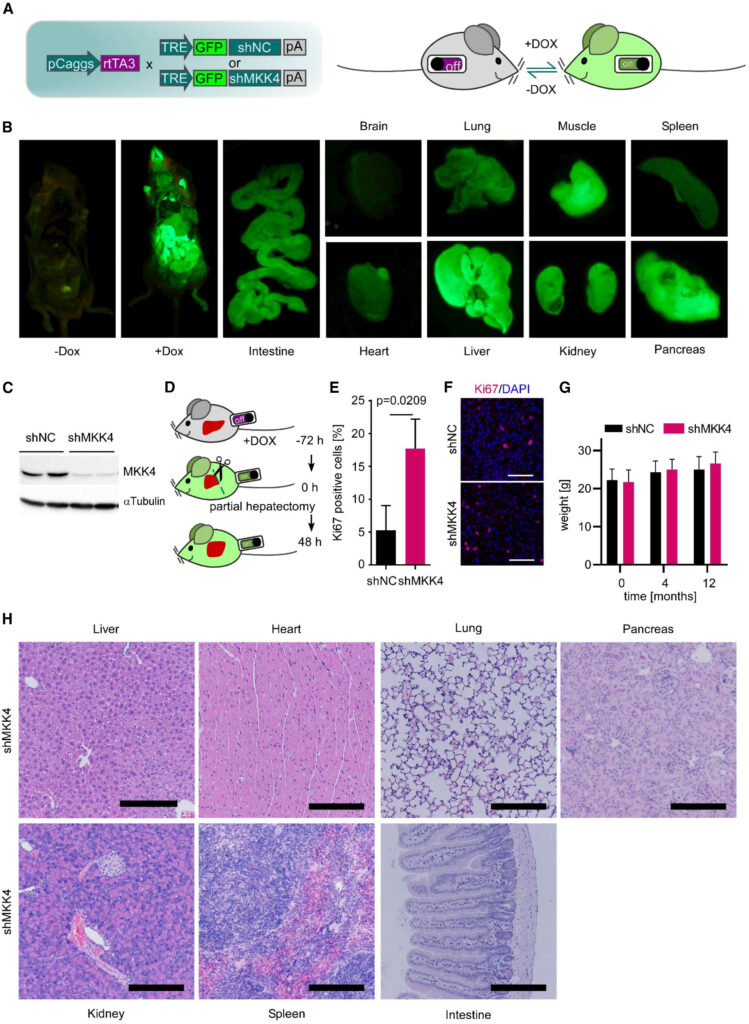
Fig. 1. MKK4의 Genetic Knockdown은 간의 재생을 향상시키고 장기간 쥐에게 안전하다.
(A) shRNA-형질전환 마우스의 생성. TRE-GFP-shMKK4 또는 TRE-GFP-shNC 마우스는 pCaggs-rtTA3 마우스와 교배되어 전반적인 DOX-유도성 MKK4 knockdown를 가능하게 했습니다.
(B) DOX투여 후 3일 후 지정된 장기에서 shRNA 발현의 대리 마커로서의 GFP 발현 측정. 대표적인 마우스의 GFP 형광 이미지를 표시하며, 그룹당 세 마리의 마우스가 분석되었습니다.
(C) 면역블로팅 분석에서 DOX 투여 후 5일 후 마우스 간에서의 shRNA 매개 MKK4 knockdown를 확인했습니다(두 마리 마우스에서 유래된 총 혈청 단백질).
(D) shRNA 형질전환 마우스에서 간 부분 절제술 실험. 간 부분 절제술 전 72시간 동안 DOX가 투여되었습니다. 마우스 간은 부분 절제술 후 48시간 후에 수확 및 분석되었습니다.
(E) shNC 대 shMKK4 마우스의 간 섹션에서 Ki67 양성 세포의 정량화. 비대응 t 검정을 사용하여 통계적 유의성이 계산되었습니다(n = 3), p 값: p = 0.0209. 평균 + 표준 편차.
(F) (E)에서 설명된 조건 하의 shNC 대 shMKK4 마우스 간에서 Ki67 (분홍색) 및 DAPI (파란색) 염색의 병합된 면역 형광 이미지 대표 사진. 축척 막대는 200 μm을 나타냅니다.
(G) DOX투여 12개월 동안 shNC 및 shMKK4 마우스의 체중. Sídák′s 다중 비교 검정을 사용하여 통계적 유의성이 계산되었습니다(n = 3), p 값: p = 0.9959 (0개월), p = 0.9898 (4개월), p = 0.8977 (12개월), 평균 + 표준 편차.
(H) 유전적 MKK4 억제 후 12개월 후 지정된 대표 장기의 H&E 염색. 축척 막대는 200 μm을 나타냅니다.
* Tet-Transactivator : Tet-on / off system은 테트리사이클린(TC) 또는 독시사이클린(DOX) 과 같은 테트라사이클린 유도체 투여에 의해 유전자 발현을 억제하거나 활성화한다.
[Fig 1A] 형질전환 실험쥐를 제작하고 DOX에 의해 shRNA 발현을 유도하여 knockdown을 유도하였다
[Fig 1B] 클로닝된 GFP발현량을 shRNA 발현 마커로 이용하여서 각 조직에서 shRNA의 작동을 확인하였다. 뇌, 심장, 비장에서의 발현량이 상대적으로 낮으나 간에서 발현량이 높은것으로 보아 간에서 shRNA의 작동을 확인하였다.
[Fig 1C] westernbloting으로 MKK4가 간에서 효과적으로 knockdown되었음을 최종적으로 확인하였다.
[Fig 1D-F] DOX를 사전에 72시간 투여하여 MKK4의 기능을 억제하고 간을 부분적으로 절제하여 간 세포의 분열 증식 능력을 확인한 결과 대조군에 비해 분열 증식 정도가 크게 상승하였다.
- MKK4의 억제가 간 재생 기능에 영향을 미친다는 것을 확인할 수 있다
[Fig 1G] DOX 투여를 통한 장기간(12개월) MKK4의 기능을 억제하였을 때 대조군과의 체중변화를 관찰하였을때 차이가 없는 것으로 보아 생존과 안전성에 문제가 없다고 볼 수 있다.
[Fig 1H] 장기간 MKK4기능 억제에 따른 각각의 장기의 조직 검사 결과 별다른 이상 형태가 발견되지 않았다.
- 12개월 MKK4의 억제는 암발생 혹은 기능적 이상을 가져오지 않은 것이 확인되었다.
Drug discovery process to make small molecule MKK4 inhibitor
– MKK4를 효과적으로 억제하기 위한 작은 분자 단위의 신약을 만들기 위한 과정이다.
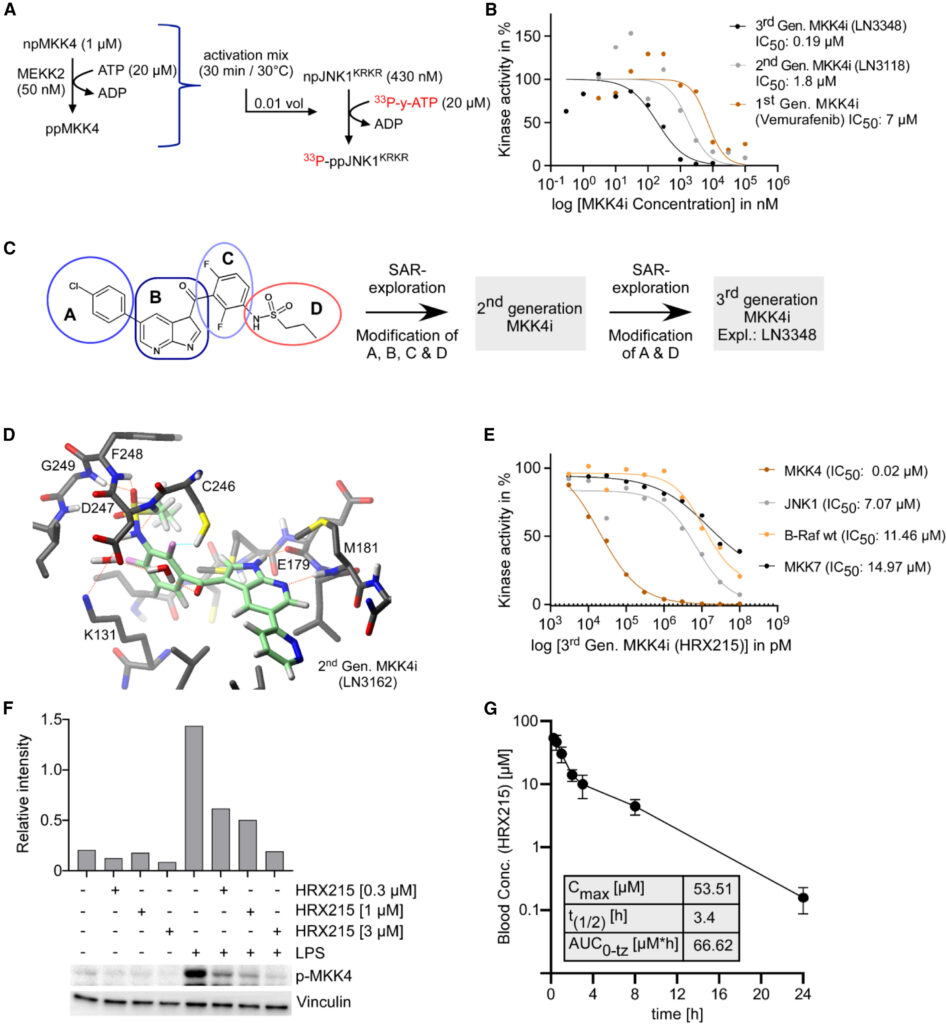
Fig. 2. 유력하고 선택 가능한 소분자 MKK 억제제 개발 및 특성 드러내기
(A) 화합물 결합에 따른 MKK4 활성 조절의 양을 측정하기 위한 33P-y-ATP 기반의 연쇄 검사. 33P-JNK 출력으로 측정 되었습니다.
(B) MKK4 라디오-연쇄 검사에서 결정된 표시된 1세대, 2세대 및 3세대 MKK4 억제제의 용량-반응 관계. 농도는 단독으로 적용되었습니다.
(D) NMR-분광법에 의해 결정된 MKK4 (회색 3D-스켈레톤 공식)에 대한 LN3162 (연한 녹색 3D-스켈레톤 공식)의 결합 모드. 포함된 아미노산이 지시되었으며 청색 점선은 리간드 플루오린의 2위치에 대한 잠정적인 Cys-SH 수소 결합을 나타냅니다. 다른 수소 결합은 빨간 점선으로 표시됩니다.
(E) HRX215 선택적 프로필. 방사성 단백질 키나제 검사에서 HRX215의 10가지 농도(10^-4에서 3 × 10^-9 M) 및 MKK4, JNK1, BRAF, 와일드 타입(WT) 및 MKK7의 키나제 활성에 대한 용량-반응 관계가 표시되었습니다. 농도는 단독으로 적용되었습니다.
(F) 분리된 PBMCs와 함께 지정된 HRX215 농도로 수행된 대상 결합 검사. l-p-MKK4 (S257)에 대한 항체를 사용하여 면역 블로팅으로 lysates를 분석했으며, 강도가 양적화되었습니다 (p-MKK4/Vinculin).
(G) C57BL6/N WT 마우스에서 결정된 HRX215의 약동학 결과. HRX215를 30 mg/kg로 경구 투여했습니다. HRX215의 혈액 농도는 5시간에서 24시간 사이에 측정되었습니다(n = 3 각각). 평균 ± 표준 편차입니다.
[Fig 2A] 33p-y-ATP 기반의 연쇄 검사 결과를 진행하기 위한 실험 모식도 이다.
[Fig 2B] 연쇄 검사 결과 vemurafenib가 MKK4에 대한 양쪽 모드 반응을 보였으며 MKK4의 활성을 억제하는 것을 볼 수 있다.
[Fig 2C] Venmurafenib의 화학적 구조에서 carbonyl과 alkyl sulfonyl 링커가 MKK4의 억제에 효과적인 기능을 가진다. 각 구조를 modification을 통해 MKK4i 를 만들어 냈다.
[Fig 2D] LN3162의 결합 모드는 단백질 내 메틸-메틸 및 단백질 리간드 NOE 교차 피크, 그리고 vemurafenib-bound BRAF 및 ZAK의 가능한 결정 구조에 기초하여 설명되었다.(PDB: 3OG7, 4RZV 및 5HES).
[Fig 2E] 방사성 단백질 키나제 검사에서 MKK4의 키나제 활성이 가장 많이 감소한 것으로 보아 HRX215가 효과적인 억제제 역할을 하고 있음을 알 수 있다.
[Fig 2F] HRX215의 세포(PBMC-peripheral blood mononuclear cells)에서의 MKK4 억제를 농도 구배로 실험하여 western blot를 실시한 결과 효과적인 감소가 보였음을 알 수 있었다.
[Fig 2G] HRX215의 경구 약동학 실시 결과 마우스에서의 제거 반감기는 3.4–3.9시간으로, 추가적인 체내 약리학 profiling이 가능하다.
Investigated whether their candidate would increase hepatocyte proliferation
– 앞선 Fig 2에서 찾아낸 신약 후보 물질이 부분 간 절제술과 CCL4로 유도된 간손상에 있어 간 증식 분열에 효과가 있는지 확인하는 과정이다.
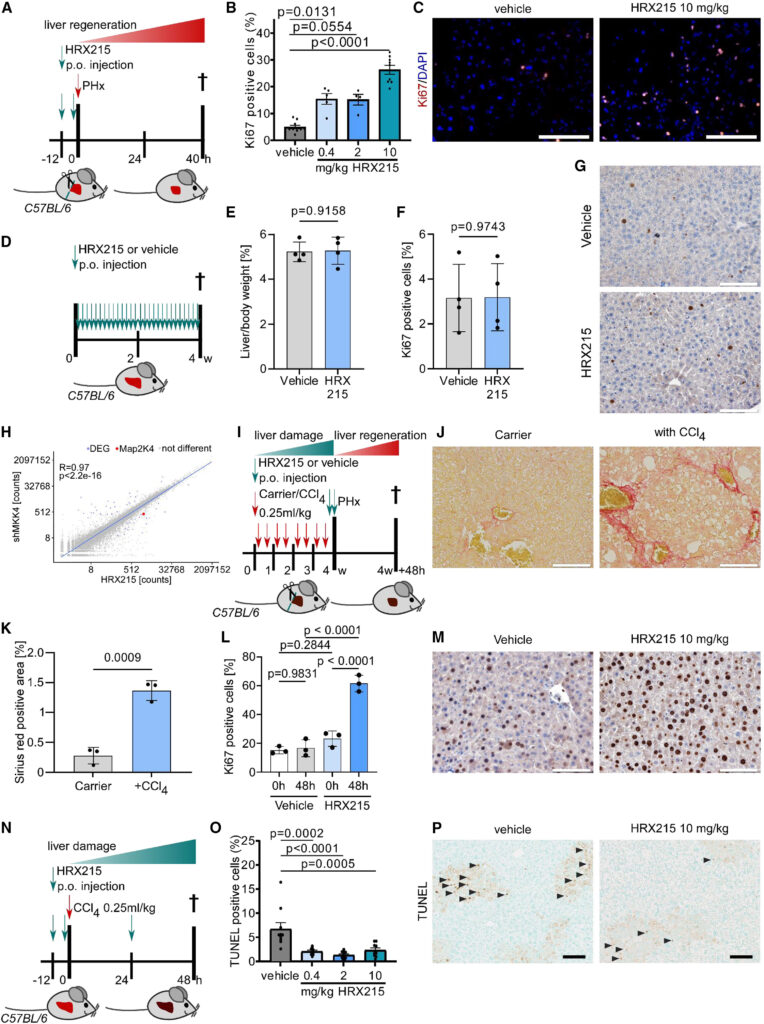
Fig. 3. HRX215은 부분 간 절제술 후 간세포 증식을 촉진하고 CCl4 간 손상 모델에서 세포 사멸을 완화합니다.
(A) HRX215 (0.4, 2, 10 mg/kg) 또는 용매(p.o.)로 처리된 C57BL/6 WT 마우스에서 수행된 부분 간 절제술(PH) 실험. 마우스는 48시간 후 안락사되었습니다.
(B) (A)에서 설명된 대로 마우스 간 섹션에서 실시된 Ki67/DAPI 염색의 정량화. Dunnett의 다중 비교 검정을 사용하여 통계적 유의성이 계산되었습니다(n은 그룹당 4에서 10으로 범위). p 값: p = 0.0131 (0.4 mg/kg HRX215), p = 0.0554 (2 mg/kg HRX215), p < 0.0001 (10 mg/kg HRX215). 평균 ± SEM.
(C) (A)에서 설명된 조건 하의 마우스 간 섹션에서 Ki67(빨강) 및 DAPI(파랑) 염색의 대표적인 이미지. 용매(왼쪽) 및 HRX215(10 mg/kg, 오른쪽)에 대한 Ki67/DAPI 염색이 표시됩니다. 축척 막대는 100 μm을 나타냅니다.
(D) C57BL/6 WT 마우스는 매일 경구 투여를 통해 HRX215(10 mg/kg) 또는 용매로 처리되었습니다. 마우스는 4주 후 안락사되었습니다.
(E) (D)에서 설명된 방식으로 처리된 마우스의 간 대 신체 무게 비율 분석. 비대응 t 검정을 사용하여 통계적 유의성이 계산되었습니다(n = 4). p 값: p = 0.9158. 평균 ± 표준 편차.
(F) (D)에서 설명된 대로 마우스 간 섹션에서 실시된 Ki67/hematoxylin 면역 조직 염색의 정량화(양성 세포 %). 비대응 t 검정을 사용하여 통계적 유의성이 계산되었습니다(n = 4). p 값: p = 0.9743. 평균 ± 표준 편차.
(G) (D)에서 설명된 조건 하의 마우스 간 섹션에서 Ki67(갈색) 및 hematoxylin(파랑) 염색의 대표적인 이미지. 차량(왼쪽) 및 HRX215(10 mg/kg, 오른쪽)에 대한 Ki67/hematoxylin 염색이 표시됩니다. 축척 막대는 100 μm을 나타냅니다.
(H) shMKK4- 및 HRX215-처리된 마우스 간 사이의 유전자 상관 분석(21,563개의 유전자). 50개의 유전자(차이가 있는 유전자(DEG): 파란색 점)가 유의하게 다르게 나타났습니다. 붉은 점: 발현이 저하된 MKK4. RNA 시퀀싱 데이터는 부분 간 절제술 후 48시간에 간을 수확하고 분석한 shMKK4 마우스 또는 HRX215(10 mg/kg)로 처리된 야생 마우스에서 추출되었습니다(n = 3). R: 상관 계수; p 값: p < 2.2e−16.
(I) (CCl4) 노출로 결합된 부분 간 절제술이 실시된 C57BL/6 WT 마우스에서 HRX215(10 mg/kg) 또는 용매로 처리됨. 3주 동안 매주 두 번 처리되었습니다. HRX215는 부분 간 절제술 전 12시간과 1시간 전에 투여되었습니다. 마우스는 부분 간 절제술 후 48시간 후에 안락사되었습니다.
(J) (I)에서 설명된 조건 하의 마우스 간 섹션에서 Sirius red 염색의 대표적인 이미지. CCl4 없는 Sirius red 염색(왼쪽) 및 CCl4 있는 Sirius red 염색(오른쪽)이 표시됩니다. 축척 막대는 100 μm을 나타냅니다.
(K) (I)에서 설명된 조건 하의 마우스 간 섹션에서 Sirus red 염색(양성 면적 %)의 정량화. 비대응 t 검정을 사용하여 통계적 유의성이 계산되었습니다(n = 3). p 값: p = 0.0009. 평균 ± 표준 편차.
(L) (I)에서 설명된 대로 처리된 마우스의 간 섹션에서 실시된 Ki67/hematoxylin 염색의 정량화(양성 세포 %). Tukey의 다중 비교 검정을 사용하여 통계적 유의성이 계산되었습니다(n = 3). p 값: p = 0.9831, p = 0.2844, p < 0.0001 (0 대 48시간 HRX215), p < 0.0001 (용매 대 HRX215 48시간). 평균 ± 표준 편차.
(M) (I)에서 설명된 조건 하의 마우스 간 섹션에서 Ki67(갈색) 및 hematoxylin(파랑) 염색의 대표적인 이미지. 차량(왼쪽) 및 HRX215 10 mg/kg(오른쪽)에 대한 Ki67/hematoxylin 염색이 표시됩니다. 축척 막대는 100 μm을 나타냅니다.
(N) 용매(p.o.)로 처리된 C57BL/6 WT 마우스에서 HRX215(0.4, 2, 10 mg/kg) 또는 용매로 처리된 화학적으로 유도된 (CCl4) 간 손상 모델의 기술 개요. 마우스는 48시간 후 안락사 되었습니다.
(O) (N)에서 설명된 조건 하의 마우스 간 섹션에서 TUNEL 염색(양성 세포 %)의 정량화. Dunnett의 다중 비교 검정을 사용하여 통계적 유의성이 계산되었습니다(n은 그룹당 9에서 10으로 범위). p 값: p = 0.0002 (0.4 mg/kg HRX215), p < 0.0001 (2 mg/kg HRX215), p = 0.0005 (10 mg/kg HRX215). 평균 + SEM.
(P) (N)에서 설명된 조건 하의 마우스 간 섹션에서 TUNEL 염색의 대표적인 이미지. 용매(왼쪽) 및 HRX215 10 mg/kg(오른쪽)에 대한 TUNEL 염색이 표시됩니다. 화살표는 TUNEL 양성 세포(갈색)를 가리킵니다. 축척 막대는 100 μm을 나타냅니다
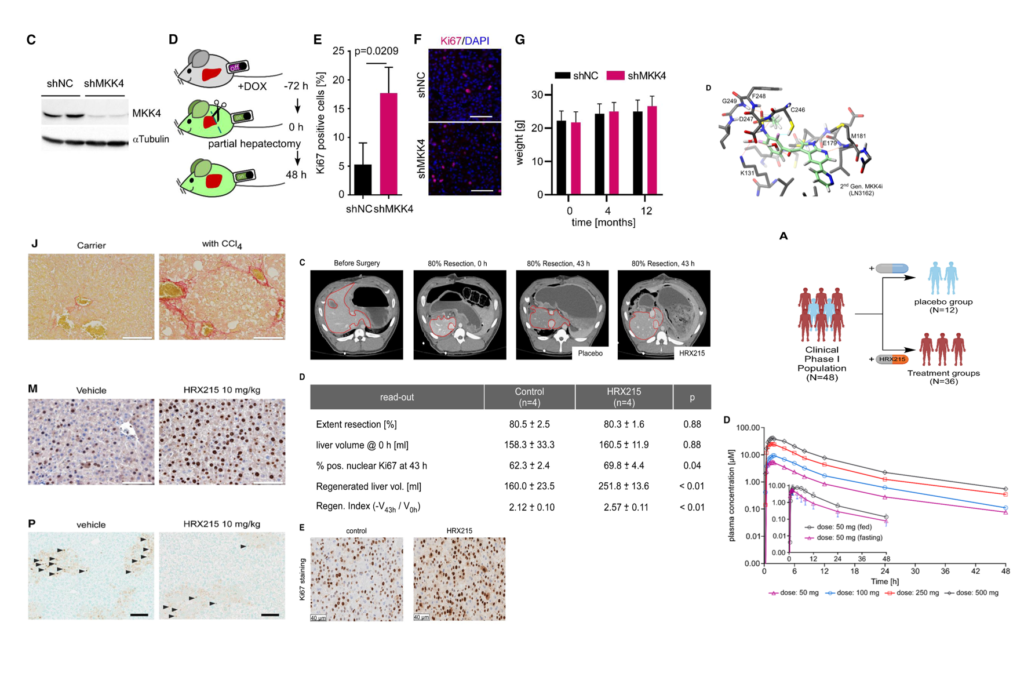
[Fig 3A] 실험쥐는 HRX215를 수술 12시간 전에 투여한 후에 간 절제 수술을 진행 하였으며 분열증식 능력은 Ki67 staining으로 측정 되었다.
[Fig 3B-C] 용매를 처리한 실험군은 4.93%의 간세포 분열 증식 능력을 보였으며 HRX215를 처리한 실험군은 15.38% 와 15.15%의 효과를 보였다.
[Fig. 3D-G] 수술 처리를 진행하지 않은 WT(wild type) 실험 쥐에 매일 용매와 HRX215를 경구 투여한 결과 간 무게 변화와 간세포의 분열 증식 능력의 변화는 관찰 되지 않았습니다.
[Fig. 3H] 각 실험군과 대조군으로 부터 얻은 RNA를 통해 mRNA seq과 전사체 분석을 진행하였다
[Fig. 3I-M] CCL4로 인해 간 섬유화증을 유발 하였음에도 HRX215를 처리할 경우 간 절제술에 이후에 간 재생 능력이 저하 되지 않음을 관찰하였다.
[Fig. 3N] CCL4에 의한 간손상을 복구하는 효과를 보기 위해 12시간전 HRX215를 처리하였고 TdT-mediated dUTP-biotin nick end labeling(TUNEL)로 정량화 하였다
[Fig. 3O-P] HRX215는 효과적으로 간세포의 죽음을 감소 시켜 간 재생이 진행이 될 수 있도록 하였다. 사진상 에서도 양성세포의 갯수가 확실히 감소된 모습을 보인다.
To characterize the safety of HRX215 on mice long term
– 다양한 표지 인자들을 통해 HRX215가 장기간 투여되었을시 안전한지를 검증하는 과정이다.
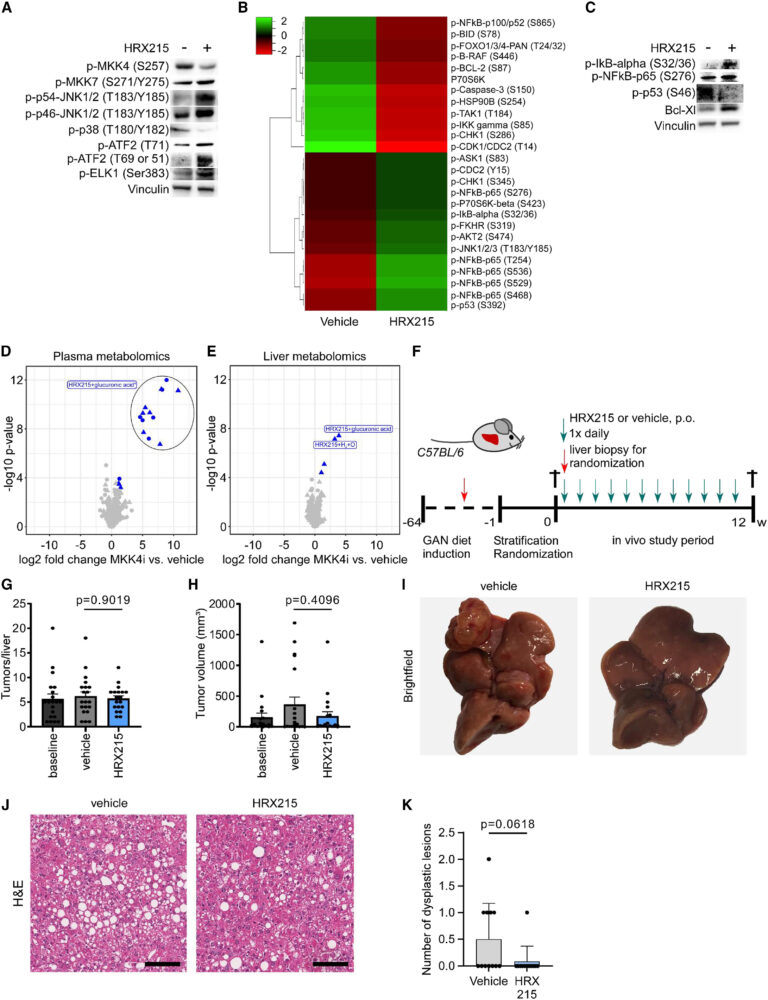
Fig. 4. HRX215의 장기간 처리의 안전성
(A) 부분 간 절제술을 받은 마우스에서 HRX215 처리에 따른 MAPK 신호 전달 연쇄의 면역블로팅 분석. 10 mg/kg HRX215가 부분 간 절제술 (PH) 전에 8시간과 1시간 전에 마우스에 투여되었습니다. 마우스는 PH 후 1시간 후 안락사되었습니다. 네 마리 마우스의 총 단백질 추출물이 각각 분석되었습니다. DMSO는 “-“로 표시되고 HRX215는 “+”로 표시됩니다.
(B) 부분 간 절제술(PH) 이후 48시간 후 간에서 추출된 전체 세포 단백질로부터의 용매 또는 HRX215로 처리된 간에서 세포 사멸 효소 단백질 배열 분석. HRX215 또는 용매는 PH 전 12시간과 1시간 전에 투여되었습니다. 실험쥐는 PH 후 48시간 후 안락사 되었습니다. 세 마리 마우스의 전체 세포 단백질은 PH 후 48시간 후에 분석되었습니다. 상위 증가한(녹색)와 감소한(빨간색) 인산화 된 단백질은 히트맵 시각화로 표시되었고 log2 폴드 변화로 계산되었습니다.
(C) HRX215 처리 하에서 부분 간 절제술을 받은 마우스 간에서 항 세포 사멸 단백질의 면역블로팅 분석. 10 mg/kg HRX215 또는 차량은 부분 간 절제술 전 12시간과 1시간 전에 투여되었습니다. 마우스는 PH 후 48시간 후 안락사되었습니다. 세 마리 실험쥐의 전체 세포 단백질은 PH 후 48시간 후에 분석되었습니다. DMSO는 “-“로 표시되고 HRX215는 “+”로 표시됩니다.
(D와 E) HRX215와 차량으로 처리된 마우스의 혈장 (D) 및 간 (E) 샘플에서 조절된 특징의 무표적 대사 분석. 혈장 샘플에서 1,337개의 특징이 발견되었으며 간 조직에서 814개의 특징이 발견되었습니다. Volcano plot는 log2 폴드 변화 대 Benjamini-Hochberg 조정된 p 값 (-log10 변환)을 보여줍니다. 절대 log2 폴드 변화 ≥ 1 및 조정된 p 값 < 0.05를 갖는 특징은 파란색으로 색칠 되었습니다. 구조적으로 주석이 달린 대사 물질은 해당 이름으로 레이블이 지정되었으며, 할당되지 않은 대사 물질은 레이블이 지정되지 않았습니다. 회색 점은 유의미하게 변경되지 않은 특징을 나타냅니다. 양 이온화 모드에서 감지된 특징은 삼각형으로, 음 이온화 모드에서 감지된 특징은 원으로 나타냅니다.
∗HRX215-글루쿠로니드는 혈장 샘플에서 다중 ESI-MS 이온화 첨가물로 검출되었습니다.
(F) 63주간의 GAN 식이 후 12주간 매일 경구 투여를 통해 HRX215 또는 용매로 처리된 C57BL/6 WT 마우스에서 수행된 GAN-NASH HCC 모델. 마우스는 총 76주 후에 안락사 되었습니다.
(G) (F)에서 설명된 대로 수확된 마우스 간에서 종양 당 간의 정량화. 용매 및 HRX215로 처리된 마우스 간의 기준선에서 종양 당 간을 비교했습니다. 통계적 유의성은 Dunnett의 다중 비교 검정을 사용하여 계산되었습니다(n = 19-20). p 값: p = 0.9019. 평균 ± SEM.
(H) (F)에서 설명된 대로 수확 된 마우스 간에서 평균 종양 결절 부피(mm2)의 정량화. 종양 부피는 용매 및 HRX215로 처리된 마우스의 기준선과 비교되었습니다. 통계적 유의성은 Dunnett의 다중 비교 검정을 사용하여 계산되었습니다(n = 19-20). p 값: p = 0.4096. 평균 ± SEM.
(I) (F)에서 HRX215 또는 용매으로 처리된 WT 실험쥐의 대표적인 간의 밝은 필드 이미지.
(J) (F)에서 HRX215 또는 차량으로 처리된 WT 실험쥐의 대표적인 간의 H&E 염색. 축척 막대는 100 μm을 나타냅니다.
(K) (F)에서 사용된 마우스의 간에서 HRX215 또는 용매로 처리된 간에서 비정형 병변의 정량화. 통계 분석은 비대응 t 검정을 사용하여 수행되었습니다(n = 12). p 값: p = 0.0618. 평균 ± SD
[Fig 4A] MKK4i 투여된 마우스가 부분 간절제술을 받을 때 이러한 주요 신호 이벤트가 확인되었으며 이는 MKK4 억제의 간세포 안정화 표현형에도 기여할 것으로 보인다.
[Fig 4B-C] 유전자 발현량 변화 확인에서 p38와 p53, NF-kB 신호전달 활성화 능력이 감소하였으며, 항 아포톱시스 단백질 Bcl-XL이 증가하였다. 이들은 간세포 안정화 표현형에 기여할 것으로 보인다
[Fig 4D-E] Untargeted metabolomics를 진행한 결과 HRX215 처리 그룹의 독특한 발견은 HRX215 대사물질로부터 유도되었다. 마찬가지로, 간 조직에서 두 그룹 간에 독특하게 주석 달린 대사 물질은 오직 HRX215 유도체로 확인되었다.
[Fig 4F-H] 비알콜성 지방간염 모델에서 장기간 암형성 연구를 진행하였다. 사전에 GAN를 12주간 급여해 지방간염을 유도하고 매일 HRX215와 용매를 60주간 투여해 변화를 관찰하였다.
[Fig 4I-J] 실험군과 대조군 모두 비슷한 양의 암종이 발견되었으나 HRX215를 처리한 군에서는 암종의 크기가 작은 것을 확인할 수 있었다.
[Fig 4K] 실험군과 대조군 사이에 과립구 형성양의 차이는 보이지는 않았지만 HRX215를 처리한 실험군은 이미 형성된 암종의 증가와 전이는 보이지 않았다.
To probe HRX215's capacity to enhance liver regeneration in porcine hepatectomy model
– 돼지에게 간 절제술을 시행한 후 HRX215 처리를 통해 간 재생 능력을 확인하고 인간 모델에 적용시킬 수 있는지 확인한다.
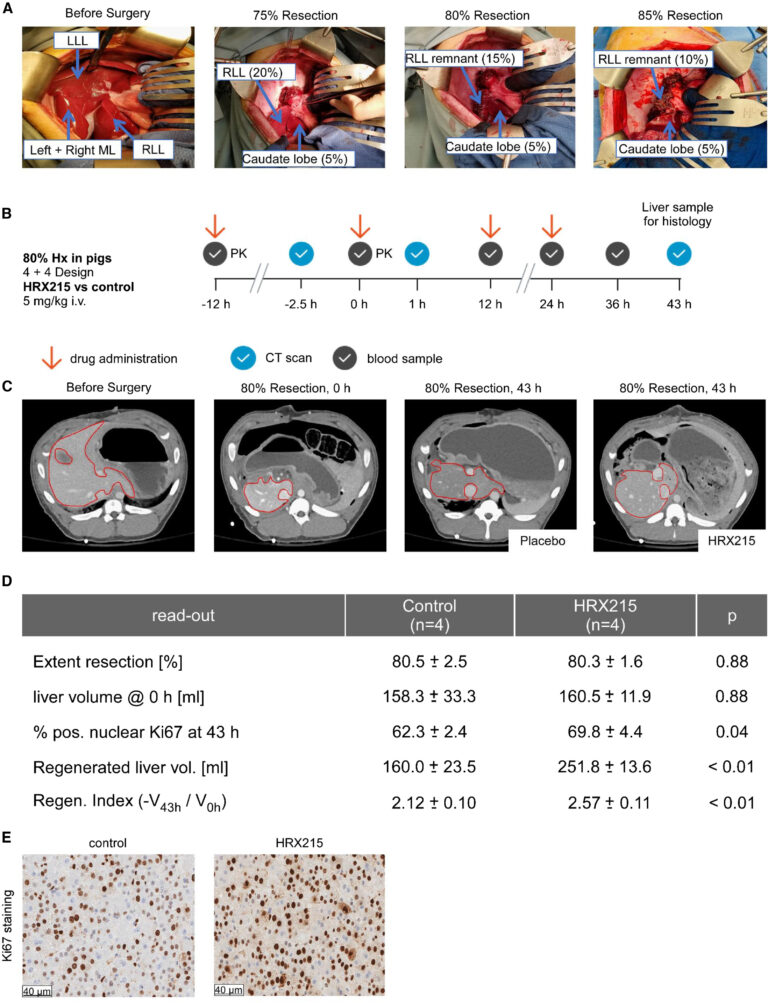
Fig. 5. HRX215는 돼지에서 80% 간 절제술 후 간 재생을 촉진합니다.
(A) 돼지 간을 절제한 사진(75%, 80%, 및 85% 절제). 잔여 간 용적이 보여집니다. LL, 왼쪽 간 연절; M, 중간 연절; RLL, 오른쪽 간 연절.
(B) 80% 절제술이 진행된 간에 HRX215 (5 mg/kg 정맥 내주 [i.v.]) 또는 용매로 처리한 연구. 표시된 시간대에서 CT 스캔 (파란 원) 및 혈액 채취 (회색 원)가 수행되었습니다. 돼지는 수술 후 43시간 후 안락사 되었습니다.
(C) 80% 간절제술 전후의 CT 스캔은 시간대 0과 43시에 나타났습니다. 직접적 비교를 위해 휘어진 빨간 선으로 둘러싸인 간 (빨간 점선으로 표시됨)은 휴대용 처리된 돼지의 간과 HRX 215로 처리된 돼지의 간과 함께 나타냅니다.
(D) 제어된 돼지와 HRX 215로 처리된 돼지 사이에서 특정 시간대에서 간 용적, 절제 범위 및 새롭게 재생된 간 용적을 정량화 하였습니다.
(E) 제어된 돼지 (왼쪽) 또는 HRX215로 처리된 돼지 (오른쪽)의 간 섹션에서의 Ki67 염색. Ki67 양성 세포가 갈색으로 표시됩니다. 축척 막대는 40 μm를 나타냅니다.
[Fig 5A] 돼지의 간을 80-85% 절제한 모델을 통해 간 재생 능력을 보고자 한다. 80% 절제한 개체는 치명적이지 않은 반면 85% 절제한 개체는 치명적인 간 부전이 발생한다.
[Fig 5B] 시간대별로 HRX215와 용매를 처리하고 혈액 채취 과정을 보여주는 실험 진행 모식도 이다.
[Fig 5C,D] 간 절제술 이후에 간의 재생을CT 영상단면을 통해 보여주는 것으로 플라시보 약물과 비교하였을 때 간 재생 정도가 더 확연히 큰 것을 볼 수 있다. 돼지의 특정 시간대에서 간 용적 및 절제 범위를 정량화한 표를 통해서도 같은 결과를 확인 할 수 있다.
[Fig 4E] 43시간 후에 조직을 채취하여서 조직을 확인한 결과 대조군에 비해 간세포의 분열증식이 더 일어났음을 볼 수 있다.
The effect of HRX215 on 85% hepatectomy induced liver failure in pigs
– 돼지에게서 85%의 간이 절제된 상태는 간 부전을 발생시켜 간의 회복을 어렵게 한다. 이에 HRX215를 처리하여 간부전이 개선되는 효과를 보고자 한다.
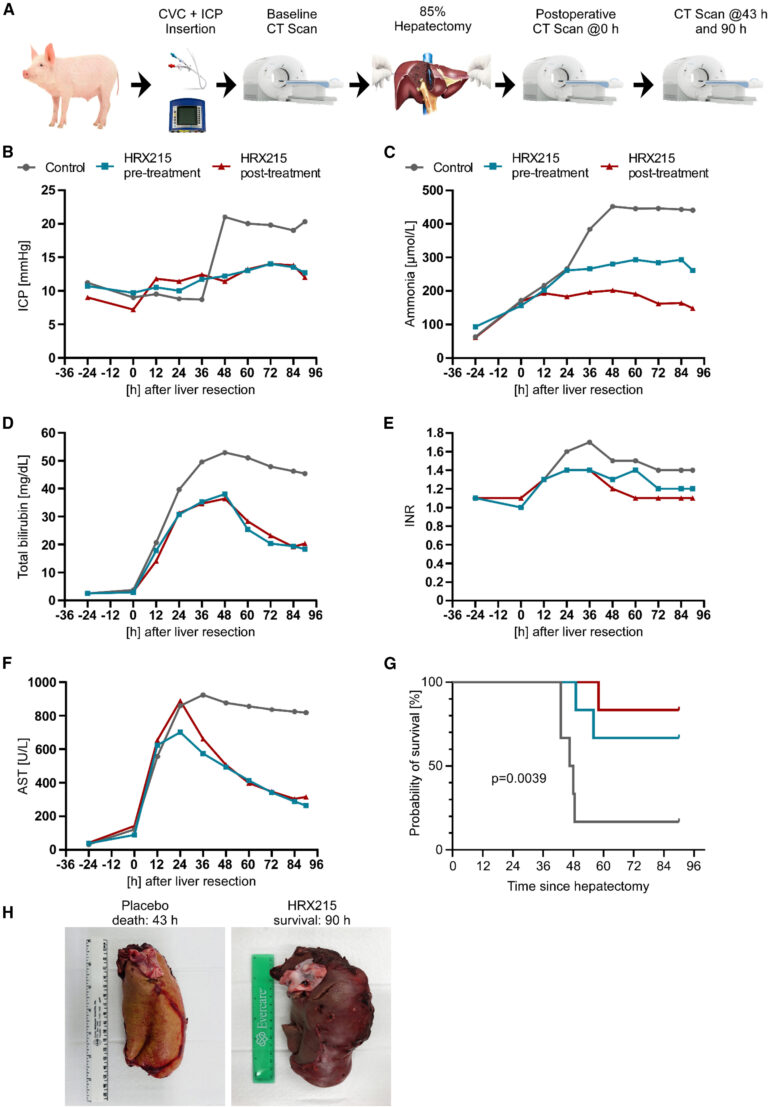
Fig. 6. HRX215는 85% 간 절제술 후 발생하는 간 부전을 예방합니다.
(A–F) (A) 돼지 85% 간절제술 실험을 위한 실험 설정 (B–F). 120시간 동안 두개내압 (ICP), 암모니아, 총 빌리루빈, INR, 및 아스파타트 아미노전이효소 (AST)의 동력을 보여줍니다 (수술 전과 후 간 절제술 치료 군에 대해). 돼지는 휴대용 처리 (회색), 수술 전 HRX215 처리 (청록), 또는 수술 후 HRX215 처리 (빨강)를 진행하였습니다 (n = 6).
(G) 플라시보 (회색), 수술 전 HRX215 처리 (청록), 또는 수술 후 HRX215 처리 (빨강)를 받은 돼지의 생존률 그래프입니다. 통계적 유의성은 로그랭크 (Mantel-Cox) 검정을 사용하여 계산되었습니다 (n = 6). p 값: p = 0.0039.
(H) 용매 (왼쪽) 또는 HRX215 (오른쪽)로 처리된 돼지의 간의 대표적인 이미지. HRX215는 85% 간절제술 후 간 부전을 예방합니다
[Fig 6A] 이 연구는 생체신호의 지속적인 모니터링과 심전도 측정(ECG), 두개내압 측정, 중심 정맥압 측정 및 모든 관련 혈액 매개 변수의 지속적인 측정 하였다.
[Fig 6B-F] 각각의 표지 인자들은 수술전과 후 변화와 약물 처리 전 후의 결과를 보여준다.
[Fig 6G] 수술 후 24시간이 지난 후 용매가 처리된 동물 중 6마리 중 5마리가 이상 행동을 보이며 이후 혼수 상태에 빠져 안락사가 필요했다. 그에 비해 HRX215로 처리된 동물 중 6마리 중 4마리 (수술 전 치료 그룹)와 6마리 중 5마리 (수술 후 치료 그룹)가 정상적인 행동을 보이고 생존했다.
[Fig 6H] 사망 시 또는 예상 채취 시점에서 검체로 채취된 간을 분석할 때, HRX215로 처리된 간은 정상적인 색상과 질감을 보여주었으나, 용매로 처리된 간은 작고 창백하고 황색을 띠며 건조하며 축소되어 있었다.
Clinical trial of HRX215 on humans
– 인간에서의 HRX215의 안정성, 내성을 검증하기 위해 임상시험을 시행하였다.
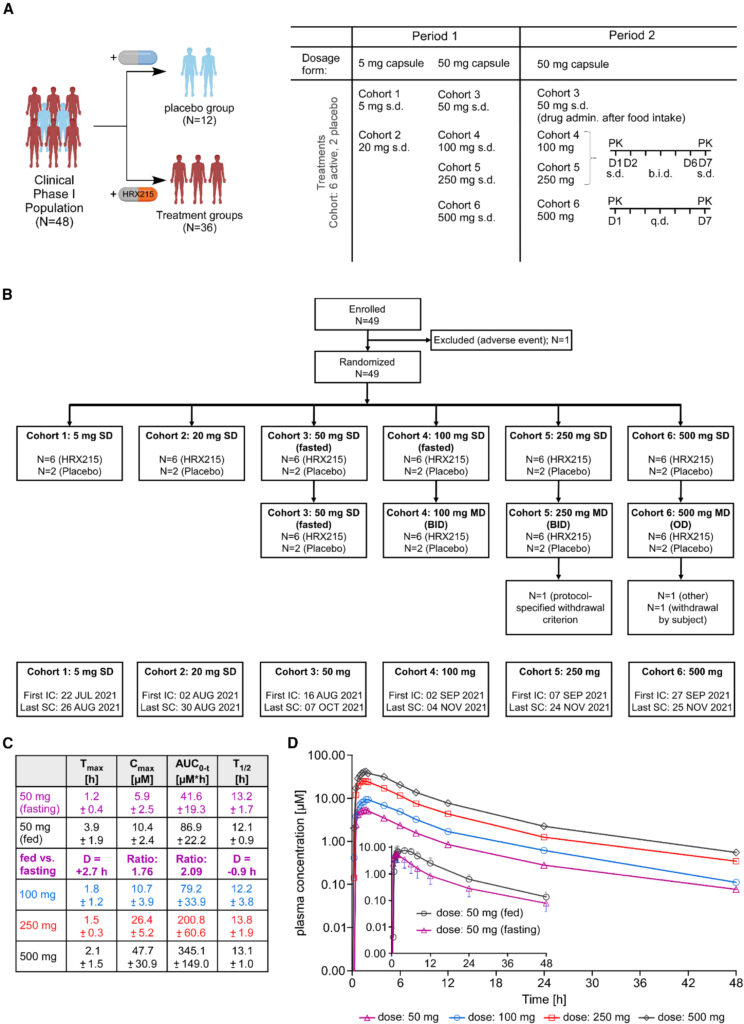
Fig. 7. HRX215의 약동학적 1상 임상 시험(FIH-first in human)
(A) 임상시험의 개요도. 왼쪽에는 플라시보(n = 12) 및 HRX215 치료 (n = 36) 그룹을 보여줍니다. 오른쪽에는 6개의 활성 및 2개의 플라시보 코호트의 용량 계획이 표시됩니다. FIH 연구에 포함된 코호트는 제1 기간 동안 단회 투여(s.d.)로 5–500 mg의 HRX215를 공복 상태에서 받았습니다. 제2 기간에는 50 mg의 단회 투여는 포식 상태에서, 100 및 250 mg의 HRX215를 하루에 두 번 (b.i.d.) 투여하고 500 mg의 HRX215를 하루에 한 번 (q.d.) 투여했습니다.
(B) Consolidated Standards of Reporting Trials (CONSORT) 흐름도.
(C) 단회 투약 (100, 250, 및 500 mg) 및 포식(fed) (검정) 대 공복 (purple) 상태의 약동학 매개 변수.
(D) 단회 투여(50–500 mg 및 50 mg) 후 혈장 내 HRX215의 약동학 프로파일. 포식(fed) (검정) 대 공복 (purple) 상태. 평균 ± 표준편차.
[Fig 7A] 임상시험의 진행 개요도를 보여준다. 48명의 남성 임상시험 자원자들을 두 그룹으로 나누어서 플라시보 약은 12명 치료약은 36명으로 치료약은 공복상태와 식후 상태인 그룹으로 나누어서 투여 받았다.
[Fig 7B] 임상시험의 흐름도에 따라 각각의 자원자들에게 투약하여 경과를 관찰하였다.
[Fig 7C-D] HRX215의 약동학을 조사하기 위해 유효화된 액체 크로마토그래피-이중 질량 분석법 (LC-MS/MS)이 사용되었으며 HRX215가 신속하게 흡수되었으며, 최대 농도에 도달한 후 제거가 이중상태로 진행되었음을 나타났다.
- HRX215의 유효할 만큼의 약동학적 효과와 안전성은 임상2상 시험을 가능하게 하였습니다.
Disscussion
본 연구에서는 MKK4 억제제 HRX215의 발견을 하였으며 이를 이용한 전임상 평가 결과는 간 질환의 치료에 새로운 관점을 제시하였습니다. HRX215은 기존의 치료법과는 다르게, 빠른 치료 효과를 제공하며, 실험 결과에서 그 효능이 입증되었습니다. 이 소분자 억제제는 간 세포의 증식과 재생을 촉진하여 간 손상 모델에서 효과를 발휘합니다. 특히, 알코올성 간염 및 비알코올성 지방간 병증 모델에서는 지방 침착을 감소 시키고, CCl4로 유도된 간손상 모델에서는 섬유화를 억제하는 것으로 나타났습니다. 실험 결과에 따르면, HRX215 투여는 안전성이 우수하며, 장기간 투여해도 부작용이 적다는 결과를 보여줍니다. 특히, 85% 간 절제 모델에서 간손상을 예방하고 생존률을 향상시키는 효과가 돼지 모델에서 관찰되었습니다. 이러한 결과는 간 이식 후 간 기능 회복을 향상시키는데 도움이 될 것으로 기대됩니다. 돼지에서의 간 절제 후 재생은 인간에서의 상황을 잘 반영하는 것으로 알려져 있기에 혁신적인 해결책이 될 수 있으나 간이식 분야에서의 최종 가치는 추가적인 임상 시험이 필요합니다. 결론적으로, HRX215은 매우 유망한 치료제 후보로, 간질환 및 간 이식 관련 합병증에 대한 치료 옵션으로서 확대된 임상 연구와 응용을 기대할 수 있습니다. 본 연구에서 실험이 진행된 기간 이상의 장기간 투여에 대한 테스트는 진행이 되어야 하지만 이러한 연구는 간 재생을 촉진하는 새로운 치료 전략을 개발하는데 기여할 것으로 보입니다.