Spatial transcriptomics을 통해 발견한 장기 기억에서 발생하는 neuron-astrocyte 간 시너지 효과
Abstract
기억은 과거의 경험을 암호화하며, 이는 미래 계획을 세우는 데 기여합니다. *Basolateral amygdala는 정서적 경험의 기초가 되는 *salience network에서 핵심 역할을 하고, 이에 따라 공포에 대한 장기적인 기억 형성에 중요한 역할을 합니다.
이 논문에서는 spatial 및 single-cell transcriptomics를 사용하여 장기 기억에서 basolateral amygdala의 역할에 관여된 세포 및 분자 구조를 조명하고자 합니다. 연구진들은 특정 뉴런 및 성상세포의 하위 집단에서 기억에 따라 다르고 몇 주 동안 지속되는 *transcriptomic signature들을 확인했습니다. 이러한 transcriptomic signature들은 neuropeptide 및 BDNF signaling, MAPK 및 CREB activation, ubiquitination pathways, 그리고 synapse connectivity를 장기 기억의 주요 구성 요소로 지목합니다. 특히 장기 기억 형성 시, 증가된 Penk 및 감소된 Tac 발현에 의해 정의된 neuronal subpopulation은 basolateral amygdala의 *memory engram 중 가장 중요한 구성 요소로 작용했습니다.
이러한 전사적 변화들은 single-cell RNA sequencing 및 손상되지 않은 뇌 조직 샘플의 single-molecule spatial transcriptomics 모두에서 관찰되어 공간 정보가 잘 반영된 memory engram을 제공합니다. 이러한 공간 데이터를 통해 연구 대상의 뉴런 하위 집단이 인접한 astrocytes(성상세포)와 상호 작용한다는 것을 결정할 수 있었으며, 기능 실험을 통해 뉴런이 장기 기억을 암호화하기 위해 astrocytes와의 상호 작용이 필요하다는 것을 보여줍니다.
* Basolateral amygdala(기저외측편도체): 해마 앞쪽에 있는 작은 구조물인 편도체의 일부로, 감정을 관장하는 역할을 수행함.
* salience network: 중요하거나 두드러진 자극을 감지하고 반응하는 뇌 영역들의 집합. 감정적으로 중요한 자극을 처리하는 데 중요한 역할을 함.
* transcriptomic signature: 세포나 세포 집단에서 발견되는 gene expression의 특정 패턴.
* memory engram: 뇌 속에서 기억이 저장되고 불러올 수 있는 특정 뉴런의 집합. 개인의 경험을 기반으로 만들어짐.
(+) engram cells: 기억이 저장되는 뇌의 특정 뉴런. 경험 및 학습을 통해 활성화되며, 기억을 형성하고 저장하는 역할을 함.
Figures
Persistent changes during fear memory recall – 실험 설계 및 진행 과정
– 이 실험의 궁극적인 목표는 recall 중에 활성화여 tdT+ cell이 된 engram cell을 포착하여, fear-specific memory gene을 파악하는 것입니다. ‘특별한 기억’만을 통해 발현된 유전자와 구분 짓는 것이 가장 큰 핵심입니다. (FR vs NF conditions; Figure 1A에 모식도)
– TRAP2 mouse에서 세포 활성화는 Fos 유전자에 내장된 tamoxifen-dependent Cre-ERT2 재조합효소의 발현을 유도합니다. 이에 따라 TRAP2 마우스를 Ai14 tdTomato (tdT) reporter mouse 와 교배하는 경우, 자극을 받고 tamoxifen에 노출될 때만 tdT를 발현합니다. (일정 비율의 background activation은 존재)
– 교배된 mouse를 대상으로 연구진들은 0일째에 공포 조건(전기 충격)을 학습시킨 후, 16일 후에 훈련 환경을 재현하는 동시에 tamoxifen을 주입하며 장기 공포 기억의 회상을 유발했습니다.
– 그 후, 장기 공포 기억 회상을 발생한 16일차로부터 9일 뒤인 25일에 spatial transcriptomics 및 full-length deep single-cell RNA sequencing(scRNA-seq)을 사용하여 mouse의 편도체를 분석했습니다.
– 위 mouse는 ‘FR(fear training after recall)’ 조건이라고 명합니다.
– 대조군으로 다음과 같은 설계를 했습니다.
HC(home cage): 케이지에 방치한 mouse
NF(no fear): training 과정 중 전기 충격을 받지 않은 mouse
NR(no recall): recall condition을 거치지 않은 mouse
A spatially resolved ensemble of engram cells
– 넓게 분포된 engram 세포들의 유전자 발현 패턴을 확인하기 위해, single-molecule resolution 단위의 spatial transcriptomics analyses를 통해, 원래의 조직 구조를 보존하면서 희소하게 분포된 *TRAPed(tdT+) engram 세포의 유전자 발현 패턴을 시각화 했습니다.
– 공포 기억 합성 시 tdT+ engram 뉴런의 수가 특히 BLA에서 증가하는 것을 확인했으며, 이 뉴런들은 기억 인코딩 및 회상 과정에서의 역할을 나타내는 독특한 유전자 발현의 종류를 보였습니다.
– 공포 조건화 및 기억 회상 과정에 대응하여 활성화된 것으로 나타난 tdT+ 뉴런을 공포 기억 합성 및 회상에 관여하는 engram 세포로 식별했으며, 이러한 세포들은 조기 반응 유전자와 neuropeptide와 관련된 차별적 유전자 발현을 보여주었습니다.
– 해당 파트에서는 BLA에서 clustering을 통해 여러 유형의 뉴런이 발견할 수 있었으며, 각 유형의 뉴런 별로 발현하는 marker gene의 존재를 확인했습니다. 나아가 tdT+ cell이 공포 조건에서 더욱 더 많이 발현하거나 적게 발현되는 gene expression을 확인했는데, 이는 NF 조건에 비해 FR 조건에서 얼마나 더 발현되었는지를 주로 봅니다.
– 다만 아래 figure에서 왜 BLA를 선정했는지는 나오지 않는데, 이는 NF mice에 대비해 FR mice에서 engram 뉴런 활성화가 가장 활발했다는 [Extended Data Fig. 1c-i]의 결과를 기반으로 진행됩니다.
* TRAPed cells: TRAP(Targeted Recombination in Active Populations)라는 genetic marking 기술을 통해 특정 자극 및 행동에서 발현되는 것이 파악된 세포. 뉴런을 예시로 들면, 활성화된 뉴런에서만 발현되는 유전자에서 함께 발현되는 것을 확인하여 해당 뉴런의 활성 상태를 파악함.

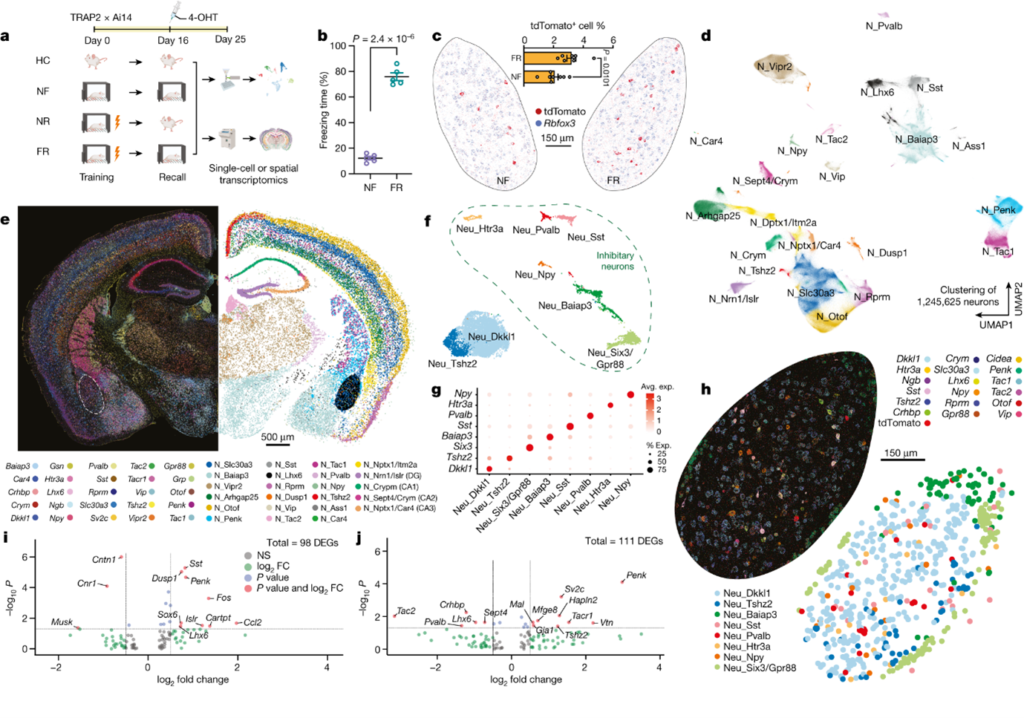
[Figure 1] Spatial transcriptomics를 통해 engram 구성 및 기억과 관련된 유전자의 파악
(A) Mouse를 대상으로 공포 반응을 관찰하기 위해 만든 fear conditioning model에 대한 실험 설계도. 해당 실험을 통해 fear conditioning model에서의 engram cell을 추적.
(B) Training 과정을 지난 후 recall phase에서의 행동 경직 비율(freezing rate)
(C-J) MERFISH(Multiplexed error-robust fluorescence in situ hybridization; 다양한 조직의 개별 세포에서 수백 가지 RNA 종의 duplication 및 spatial distribution을 동시다발적으로 측정 가능한 single-molecule 이미징 기술) 데이터를 통한 분석.
(C) Engram 세포 (tdTomato+)가 BLA에서 발현되는 것을 확인함.
(D) 모든 뉴런 종류의 clustering 결과 시각화.
(E) 뉴런 마커 및 cell-type annotation을 공간적으로 표현한 그림.
(F) Basolateral amygdala(이하 BLA) 내의 뉴런들의 clustering 결과 시각화.
(G) BLA 내 각 뉴런들의 marker gene.
(H) BLA의 뉴런 마커 및 cell-type annotation.
(I) 공포 관련 기억으로 인해 유도된 유전자 발현을 BLA의 흥분성 신경 세포에서 측정함.
(J) 공포 관련 기억으로 인해 유도된 유전자 발현을 BLA의 억제성 신경 세포에서 측정함.
[Figure 1C] TRAP 기법을 통해 ‘엔그램’ 세포(즉, tdT+ 세포)를 실제 조직 환경에서 단일 분자 해상도로 spatial transcriptomics 분석을 수행하여 시각화했습니다. 이를 통해 희소하게 분포된 엔그램 세포의 유전자 발현 패턴을 연구할 수 있었습니다.
[Figure 1D, E] 2.3백만 개 이상의 세포에서 유래한 158개의 유전자 패널을 사용하여, 1.2백만 개 이상의 뉴런을 포함하여 10대 주요 세포 클래스를 관찰했으며, 이 중 최소 23가지 유형의 뉴런이 형성되었습니다.
[Figure 1F-H] BLA 내에서 두 가지 흥분성 뉴런과 여섯 가지 억제성 뉴런을 포함한 여덟 가지 유형의 뉴런을 확인했으며, 이러한 뉴런 유형들은 Dkkl1과 Tshz2(흥분성 뉴런), Npy, Htr3a, Pvalb, Sst, Baiap3, Six3(억제성 뉴런) 등 고유의 마커 유전자를 발현합니다.
[Figure 1I, J] Differential gene expression(이하 DEG) analysis를 통해 알아낸 결과로, Figure 1A의 설계에서 제각각 부여한 FR(fear training and recall) 조건 및 NF(no fear) 조건과 관련하여 분석하였습니다. FR 조건에서 NF 조건에 비해 흥분성 뉴런에서는 초기 반응 유전자(Dusp1, Fos)와 neuropeptide 유전자 Penk가 상향 조절되었고, 억제성 engram 뉴런에서는 신경 펩타이드 유전자 Penk가 상향 조절되었으며, tachykinin 2(Tac2) 유전자는 하향 조절되었습니다.
A memory engram gene signature in the BLA
–
Engram cell을 보다 더 심도 있게 이해하기
위해 full-length deep scRNA-seq 실험을 진행했습니다. 이는 각 뉴런 당 평균적으로 약 9,144개의 유전자를 탐지할 수
있는 규모입니다.
–
해당 단락의 결과를 통해, NF 조건은 mouse에게 장기간 지속되는 gene expression 변화를
주기에 충분함을 알 수 있습니다.
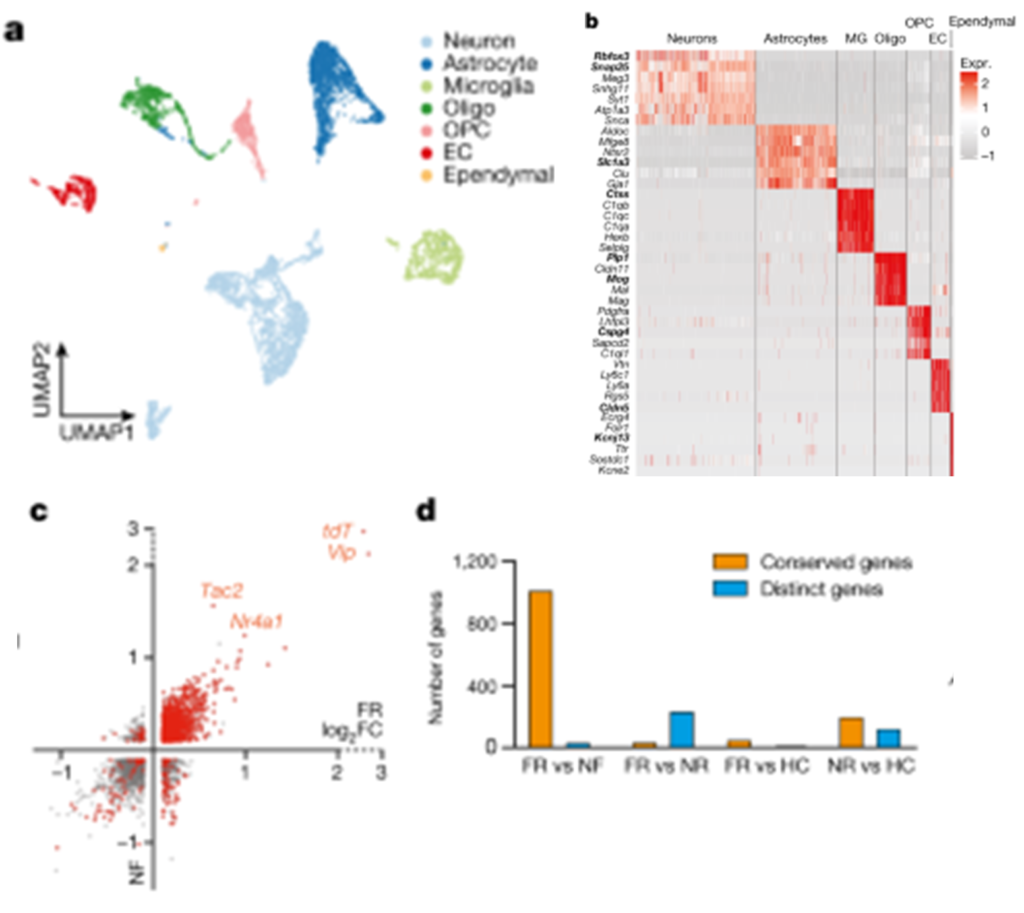
[Figure 2-1] 기억 응고화는 세포 종류에 특이적인 transcriptional programme을 일으킨다
(A) BLA 내 분석된 모든 세포에 대한 clustering 결과.
(B) 각 neuron cluster 안에 있는 서로 다른 marker.
(C) TRAPed 뉴런의 DEG. 비교 대상은 non-TRAPed 뉴런이며, x축은 FR, y축은 NF 조건을 의미.
(D) TRAPed 뉴런에서 발현이 증가한 유전자에 대한 정량적인 정보. FR 및 NF끼리는 gene expression이 유사하나, FR 및 NR사이에는 차이가 발생.
[Figure 2A, B] 단일 세포 RNA 시퀀싱(scRNA-seq) 실험을 사용하여 BLA의 6,361개 세포의 전사체를 분석한 결과입니다. BLA의 6,361개 세포의 전사체를 분석하여 뉴런(Rbfox3+), astrocytes(Slc1a3+), microglia(Ctss+), oligodendrocytes(Plp1+), OPCs(Cspg4+), endothelial cells(Cldn5+), 그리고 epithelial cells(Kcnj13+)를 포함한 모든 주요 세포 유형을 식별한 결과, scRNA-seq 결과 및 spatial transcriptomics 분석 결과가 서로 크게 연관되어 있음을 확인했습니다. 이는 곧 각 cell type의 relative abundance가 공포 조건에서 잘 보존된다는 것을 의미하며, 공포 자극을 길게 하더라도 BLA의 세포 구조를 변형하지는 않는다는 것 또한 알 수 있습니다.
[Figure 2C, D] tdT+ 뉴런을 특징짓는 유전자를 분석한 결과, tdT 외에도 신경 펩타이드(예: 혈관활성 장 펩타이드(Vip) 및 Tac2) 및 즉각 초기 유전자 Nr4a1이 tdT+ 뉴런에서 풍부하게 발현되는 것으로 나타났습니다. 이러한 유전자들은 FR과 NF 조건 모두에서 일관되게 관찰되었지만, HC와 NR 조건에서는 관찰되지 않았습니다.
Memory-associated gene expression
– BLA의 뉴런 중 세 가지는 glutamatergic(흥분성)이고 네 가지는 GABAergic(억제성)으로, 특히 GABAergic 억제 뉴런 집단인 BLA.Int.Gpr88에서 FR 조건 아래에 tdT+ 뉴런의 수가 NF에 비해 눈에 띄게 많았습니다. 이러한 변화는 Gpr88, Sv2c, Cacng5의 발현으로 확인할 수 있었습니다.
– Engram 뉴런의 remote memory recall을 통해 특이적으로 발현된 transcriptional 변화를 탐지하기 위해 FR mice 및 NF mice 간 TRAPed tdT+ 뉴런의 DEG를 진행했습니다.
– 뉴런은 기억 합성 동안 신경 펩타이드의 생산을 전환하여, 신경 펩타이드가 장기 기억 형성에서 핵심 요소로 작용함을 시사합니다.
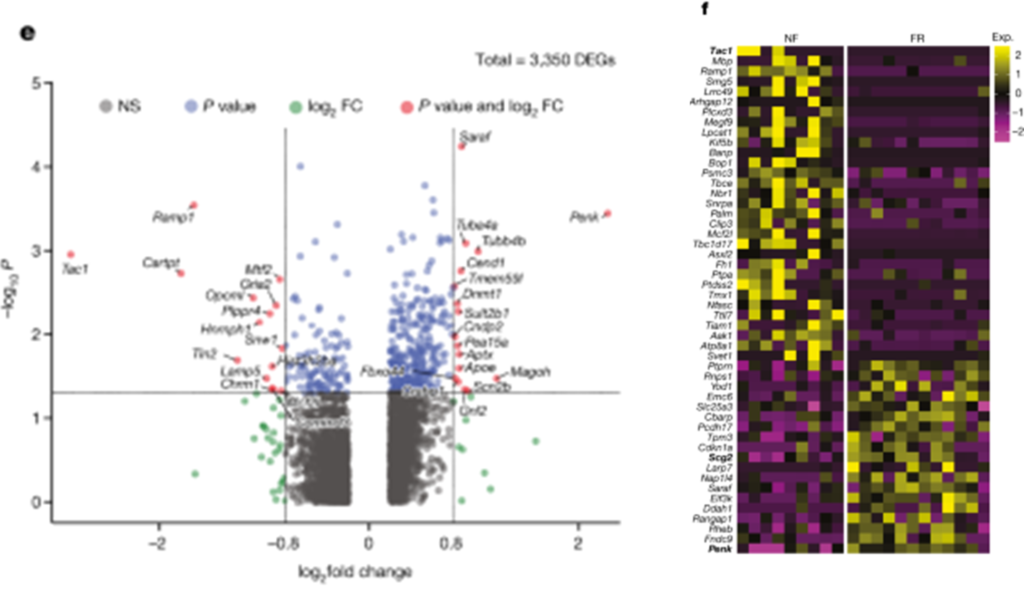
[Figure 2-2] 기억 응고화는 세포 종류에 특이적인 transcriptional programme을 일으킨다
(E) TRAPed BLA.Int.Gpr88 뉴런에서 FR 및 NF 사이의 DEG를 보여 주는 volcano plot.
(F) TRAPed BlaIn.Gpr88 뉴런에서 FR 및 NF 간의 DEG 결과. 각 column은 세포 하나를 의미함.
[Figure 2E] 원격 기억 회상에 의해 특별히 유도된 전사 변화를 식별하기 위해, FR 조건과 NF 조건의 tdT+ 뉴런에서 차별적으로 발현된 유전자(DEGs)를 스크리닝했습니다. 엄격한 기준을 적용하여 비특이적 DEGs를 제거한 결과, 6가지 유형의 뉴런에서 ‘원격 기억 관련 DEGs’ 107개를 식별했습니다. 억제성 뉴런, 특히 GABAergic 억제 뉴런인 BLA.Int.Gpr88과 BLA.Int.Crhbp는 다른 뉴런 유형보다 더 많은 차별적으로 발현된 유전자를 보여, BLA 내 억제성 뉴런이 기억 합성에 더 적극적으로 관여하는 것을 시사합니다.
[Figure 2E] MAPK 경로와 BDNF 신호 경로에 관련된 유전자들이 공포 기억에 의해 차별적으로 조절되는 것을 발견했습니다. 이는 MAPK 및 BDNF 경로가 amygdala에서의 공포 기억 합성을 포함한 다양한 학습 패러다임에서 기억 합성에 중요하다는 것을 일관되게 지지합니다.
[Figure 2F] Immediate-early genes(IEGs)는 시냅스 가소성과 관련이 있을 뿐만 아니라, 특정 IEGs가 공포 기억의 장기 합성에 의해 조절되는 것으로 나타났습니다. 억제성 뉴런 중 BLA에서 engram 특이적 유전자 발현 변화를 보인 것을 바탕으로, 이러한 억제 뉴런을 더 세분화하여 분석한 결과, 기억 합성과 관련된 159개의 유전자를 발견했습니다. CREB 신호 경로의 타겟 유전자가 풍부하게 발현되는 것이 확인되었습니다.
The role of astrocyte remodelling(1)
– Neuron-glia interaction은 memory consolidation에 필수적인 역할을 한다고 여겨집니다. 또한 astrocyte는 뉴런 활동을 감지하고 이에 따라 반응하는 것으로 알려졌습니다.
– 해당 파트에서는 engram 뉴런에서 기억 형성 중 neurotension(Nts) 발현이 유도되며, astrocyte에서 발현된 neurotensin receptor gene Ntsr2의 존재 또한 확인합니다. 이 둘 간의 연관성을 통해 장기 기억 형성이 astrocyte에서 유도된 지속적인 유전자 발현 변화로부터 영향을 받을 가능성을 시사합니다.
– 1,637개의 astrocyte를 clustering하여 5가지 세포 상태(Astro_1–Astro_5)를 식별했으며, 이는 astrocyte 하위 유형으로 파악됩니다. Cellular trajectory analyses를 통해 이러한 subtype들 사이를 연결하는 cellular pathway를 제안합니다.
– Astrocyte는 뉴런 및 다른 유형의 glia와의 지엽적 상호작용에 참여합니다. 특히, Astro_4 세포는 Fos의 상대적으로 높은 발현 수준을 보여, 최종 astrocyte 세포 상태가 활성 상태임을 시사합니다. 기억 합성은 Astro_2에서 Astro_5 세포로의 전환을 촉진하고 Astro_1 세포의 비율을 감소시켰습니다.
– Astrocyte의 Syne1 발현은 기본 조건에서 BLA에서 상대적으로 낮지만 FR 조건에서 유도되었습니다. 이러한 활성화된 Astro_4 세포에서는 prostaglandin D 합성에 관여할 수 있는 유전자가 유의하게 유도되었습니다.

[Figure 3] Remote memory consolidation는 astrocyte를 활성화한다
(A) BLA 내부의 astrocytes에 대한 cellular trajectory.
(B) FR 및 NF astrocytes의 Fos 발현.
(C) FR 및 NF astrycptes의 Aldh1l1, Syne1 및 Utp14b transcripts에 대한 RNAscope in situ staining.
[Figure 3 전반] Non-neuronal cell들 중 astrocytes에서만 remote memory consolidation과 관련된 지속적인 transcriptional 변화가 일어났습니다.
[Figure 3A] Astrocytes subtype 간의 cellular pathway를 제시하며, 이는 RNA 및 유전자 발현 패턴을 기반으로 한 cellular trajectory analyses을 통해 식별된 astrocyte의 다양한 세포 상태를 연결합니다. 이는 기억 합성 과정에서 astrocyte가 경험하는 변화와 그들 사이의 연결성을 시각화합니다.
[Figure 3B] 기억 합성이 astrocyte의 활성 상태를 어떻게 변화시키는지를 보여줍니다, 특히 FR 조건에서는 Astro_1 상태에서 덜 활성화된 astrocyte가 Astro_5 상태로 이동하여 더 활성화된 상태를 나타내는 것을 관찰할 수 있습니다. 이는 기억 합성이 특정 astrocyte 상태의 전환을 촉진하고, 그로 인해 astrocyte의 활동 패턴이 변화함을 나타냅니다.
[Figure 3C] 기본 조건하에서 BLA 내 astrocyte의 Syne1 발현이 낮지만, FR 조건에서는 보다 많은 발현량을 보여줍니다. 이는 장기 기억 형성 과정에서 특정 유전자의 발현이 활성화되는 방식을 시사하며, 특히 Syne1이 장기 기억과 관련된 astrocyte 활성화에 중요할 수 있음을 제시합니다.
The role of astrocyte remodelling(2)
– 앞서 astrocyte의 변화를 통해 Syne1과 같은 유전자가 공포 조건에서 발현됨을 확인했습니다. 해당 단락에서는 astrocyte의 활성화가 실제로 memory formation에 영향을 주는지를 확인하고자 합니다.
– 연구진들은 BLA에서의 공포 기억 형성 동안 astrocyte 활성화가 기억 형성에 기여하는지 기능적으로 평가하기 위해, astrocyte에서 칼슘을 제거하는 세포막 Ca2+ ATPase인 CalEx의 발현을 사용하여 astrocyte 활성화를 선택적으로 억제했습니다. (Figure 4A에서 실험 모식도 제공)
– Astrocyte 활성화 억제는 맥락적 및 유도된 공포 기억 모두를 손상시켰지만, 변경된 맥락에 대한 반응은 변하지 않고 낮게 유지되었습니다. 이러한 결과는 astrocyte의 활동이 기억 형성과 기능적으로 연결되어 있음을 더욱 뒷받침합니다.
Astrocyte-neuron interactions
– Engram 뉴런은 amygdala 및 기타 뇌 영역에 무작위로 분포되어 있다고 여겨지지만, 기억 형성 및 검색에 있어 amygdala의 공간적인 구조가 중요할 때가 가끔 있습니다.
– Perineuronal nets(주변 뉴런망)은 물리적 장벽의 일종으로서 뉴런의 전기 활동을 조절하는 역할을 수행합니다. Perineuronal nets는 장기 기억에 대해 암호화된 정보를 제공하는 역할을 하는 것으로 여겨지고 있으며, 곳곳에 퍼진 engram 세포를 적절히 할당함으로써 기억의 정밀성이 필요하고, 원격 기억 검색을 위한 기억 안정화에 기여한다고 알려져 있습니다.
– Engram 뉴런을 둘러싼 특정한 공간 세포 환경이 engram 뉴런과 관련이 있는지를 테스트하기 위해, BLA 내 tdT+ 뉴런을 둘러싼 세포들(반경 30µm 이내)을 분석했습니다.
– 또한 훈련 3주 후, 변화 전의 맥락 및 변화 후 맥락에 대해 맥락적 기억이 어떻게 드러나는지, 유도된 공포 조건화 테스트 및 오픈 필드 테스트를 통해 mouse를 평가했습니다.
– 종합적인 결과로, BLA에서의 Igfbp2 knockout은 맥락적 공포 및 유도된 공포 조건 모두에서 뚜렷한 결핍을 초래했습니다. 그러나 변화된 맥락 공포에 대해서는 지속적으로 공포 반응을 확인할 수 없었습니다.
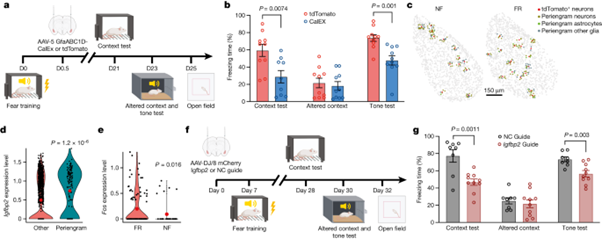
[Figure 4] Astrocyte 활성은 long term memory consolidation을 조절한다
(A) 실험 모식도. GfaABC1D-mCherry-CalEx를 보유하는 AAV를 fear conditioning training이 끝난 지 12시간 된 BLA C57B/6 mice에 주사했음.
(B) CalEx를 발현(astrocyte 활성 억제)하는 mouse는 맥락 테스트에서 tdT 대조군에 비해 경직 반응이 감소. 두 그룹 모두 변경된 맥락에서는 비슷한 동결 반응을 보였지만, CalEx 그룹은 음향 테스트에서 tdT 대조군보다 동결 반응이 감소.
(C) MERFISH 분석을 통해 공간 분포를 반영하여 tdT+ 뉴런을 둘러싸는 peri-engram 세포를 나타냄.
(D) lgfbp2 발현은 tdT+ 뉴런 주변의 astrocyte에서 높아짐.
(E) MERFISH 데이터 분석을 통해 Fos 발현은 peri-engram astrocytes 중 FR 조건을 거친 경우가 NF 조건의 경우보다 높음.
(F) 실험 모식도. U6-lgfbp2 guide RNA (gRNA)를 보유하는 AAV를 공포 조건 훈련 7일 전에 CAG-Cas9 mice에 주입.
(G) lgfbp2 gRNA를 발현하는 마우스는 맥락 테스트에서 경직 반응이 감소.
[Figure 4A] astrocytes에서 칼슘을 제거하는 CalEx의 발현을 통해 BLA에서의 astrocyte 활성화를 선택적으로 억제하는 실험 절차를 보여줍니다. 이는 공포 조건화 훈련 후, 특정한 astrocyte-specific promoter 하에 CalEx를 발현하는 AAV를 mouse에게 양측으로 주입하는 과정 및 이후 공포 반응 실험 과정을 시각적으로 설명합니다.
[Figure 4B] astrocytes 활성화 억제가 어떻게 맥락적 및 유도된 공포 기억에 영향을 미치는지 결과를 보여줍니다. astrocytes 활성화를 억제한 mouse는 맥락적 및 유도된 공포 기억 테스트에서 기억 손상을 경험했으나, 변경된 맥락에 대한 반응은 변하지 않고 낮게 유지되었습니다. 이 결과는 astrocytes 활성화가 기억 형성에 중요한 역할을 함을 시사합니다.
[Figure 4C] BLA 내 tdT+ 뉴런을 둘러싼 세포들을 분석한 결과, engram 주변 astrocyte에서 Igfbp2의 발현이 풍부하게 나타났습니다. 이는 특정 세포의 공간적인 환경이 engram 뉴런과 관련될 수 있음을 시사합니다.
[Figure 4D] Engram 주변 뉴런에서의 유전자 발현 패턴은 다른 뉴런과 구별되지 않았으나, 주변 astrocyte에서는 Igfbp2의 발현이 특히 두드러지게 되었습니다. 이는 astrocyte가 기억 형성에 특별한 역할을 할 수 있음을 나타냅니다.
[Figure 4E] Engram 주변 astrocyte는 FR 조건에서 NF 조건보다 더 높은 Fos 활성화를 보였습니다. 이는 기억 합성에 의한 astrocyte의 활성화를 나타냅니다.
[Figure 4F] 기억 형성에 대한 Igfbp2의 증가된 발현의 기능적 중요성을 확립하기 위해, 공포 기억 유도 전에 BLA에서 Igfbp2를 삭제하는 실험을 진행했습니다. 공포 훈련 전 7일에 Cas9를 발현하는 마우스의 BLA에 Igfbp2-특이적 gRNA를 인코딩하는 AAVs를 양측으로 주입했습니다.
[Figure 4G] Igfbp2 knockout은 BLA에서 맥락적 공포 및 유도된 공포 조건 모두에 있어 뚜렷한 공포 반응을 초래했습니다. 그러나 변경된 맥락에 대한 반응은 뚜렷하지 않았으며, 오픈 필드 실험에서는 Igfbp2 제거 후 행동 변화가 감지되지 않았습니다.
A memory link between PFC and amygdala
– 공포에 대한 기억의 형성이 두뇌의 서로 다른 영역들에 의해 발생하는 것은 맞지만, mPFC(medial prefrontal cortex; 내측전전두엽. 기억 및 의사결정에 관여하는 뇌의 영역) 및 amygdala는 그 과정에서도 특히 기여가 큰 것으로 알려져 있습니다.
– 해당 파트에서 연구진들은 mPFC에서의 scRNA-seq 데이터를 이용해, BLA 및 mPFC의 뉴런들을 통합적으로 분석하여 공통적인 gene-expression signature가 있는지 파악합니다. 이를 통해 장기 기억 형성에 공통적으로 기여하는 부분이 있는지 검증하고자 합니다.
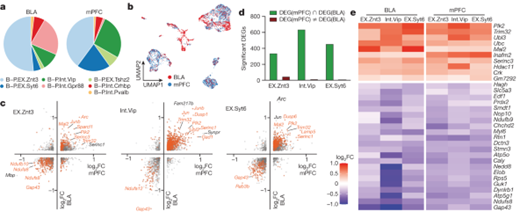
[Figure 5-1] mPFC 및 BLA의 engram 뉴런들은 장기 기억 형성 과정 중 transcription 양상이 비슷하다
(A) BLA 및 mPFC의 세포 구성.
(B) BLA 및 mPFC 뉴런들을 통합적으로 clustering한 결과.
(C) 각 뉴런 유형인 EX.Znt3(왼쪽), Int.Vip(중간) 및 EXT.Syt6(오른쪽)에 있는 TRAPed 세포에 대한 DEG 결과. 각 축은 NF에 비해 FR 조건에서 유전자의 fold change를 보이며, x축은 mPFC, y축은 BLA를 의미.
(D) 뉴런 집합 1-3에서 유의한 DEG에 대한 양 측정.
(E) TRAPed cell의 NF 조건 대비 FR 조건에서 BLA 및 mPFC의 뉴런 중 B-P.EX.Znt3, B-P.Int.Vip 및 B-P.EX.Syt6에 대한 DEG 결과.
[Figure 5A] BLA와 mPFC에서 발견된 일곱 가지 뉴런 유형 중 여섯 가지가 두 영역 모두에서 발견되었고, Gpr88 뉴런은 BLA에만 특이적으로 나타났음을 보여줍니다. 이는 두 뇌 영역의 뉴런이 공통적인 특성을 공유하고 있음을 나타냅니다.
[Figure 5B] 뉴런 유형에 따른 분류와 특정 마커의 표현을 나타내며, BLA와 mPFC의 뉴런이 어떻게 서로 연결되어 있는지를 보여줍니다. 이는 두 뇌 영역 간의 기능적 연결을 시각화합니다.
[Figure 5C] BLA와 mPFC에서 공통적으로 변화한 유전자들을 식별한 결과를 보여주며, 장기 기억 형성에 관여하는 유전자들이 두 영역에서 일관되게 조절되고 있음을 나타냅니다.
[Figure 5D] 공통적으로 조절되는 유전자들이 대부분 같은 방향으로 조절되고 있음을 보여주며, 이는 두 뇌 영역에서 유사한 전사적 변화가 기억 합성 과정에서 발생하고 있음을 시사합니다.
[Figure 5E] BLA와 mPFC의 가장 많은 세 종류의 뉴런 유형(EX.Znt3, Int.Vip 및 EX.Syt6) 내에서 장기 공포 기억에 의해 일관되게 조절되는 32개의 유전자를 나타내며, 이는 특정 유전자들이 두 뇌 영역에서 기억 합성에 중요한 역할을 함을 시사합니다.
Conserved neuron-to-astrocyte interaction
– 위에서 언급된 보존된 메커니즘 외에도 neurotensin이 mPFC 및 BLA의 흥분 뉴런에서 모두 발현되었음을 확인했습니다. Neurotensin은 연관성 기억을 관장합니다.
– 이는 neurotension, secretogranin, CART 등의 neuropeptide들이 BLA engram 세포에서 기억 장기화에 기여함을 시사합니다.
– 해당 논문에서의 결과들을 종합적으로 살펴보았을 때, 기억 형성에 있어 astrocytes의 구조 변화가 매우 중요한 역할을 한다는 것을 알 수 있습니다.
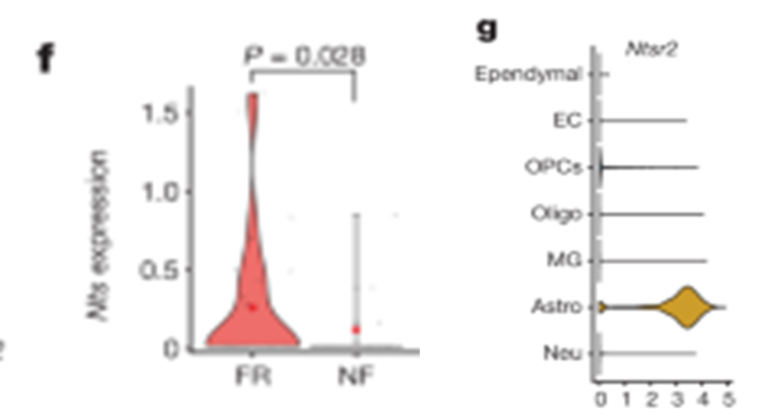
[Figure 5-2] mPFC 및 BLA의 engram 뉴런들은 장기 기억 형성 과정 중 transcription 양상이 비슷하다.
(F) BLA의 tdT+ B-P.EX.Syt6 뉴런에서의 Nts 발현.
(G) BLA에서 발견한 모든 세포에서 Ntsr2의 발현을 관찰. Ntsr2는 astrocytes에서 높게 발현됨을 확인.
[Figure 5F] mPFC와 BLA에 있는 Syt6-positive 흥분 뉴런에서 neurotensin이 발현되었고, BLA에서는 이 neurotensin이 공포 기억 형성 과정에 의해 증가했습니다. 그러나 PFC 내의 engram 뉴런에서는 neurotensin이 증가하지 않았습니다. 이는 neurotensin 같은 신경 펩타이드가 BLA 내 기억 합성에 중요한 역할을 한다는 것을 보여줍니다.
[Figure 5G] BLA 내에서 astrocyte는 주로 Ntsr2를 발현하는 반면, Ntsr1은 거의 발현되지 않습니다. 이는 Ntsr2가 BLA 내에서 astrocytes와 뉴런 간의 상호작용에 중요하다는 것을 나타내며, 특히 맥락적 공포 기억 형성에 필수적인 역할을 합니다. 이러한 발견은 BLA에서 뉴런과 astrocyte 간의 복잡한 상호작용이 기억 합성 과정에 어떻게 기여하는지를 보여줍니다.
Summary
정보는 처음에는 최근 기억으로 저장되고, 시간이 지나면서 기억 합성 과정을 통해 장기 기억으로 변환됩니다. 연구진들은 activity-dependent cell trapping과 spatial & single-cell transcriptomics 분석, 그리고 in vivo 실험을 통해 다음과 같은 발견을 주로 해냈습니다.
(1) 기억에 의해 활성화되는 astrocyte의 변화 경로를 확인했습니다.
(2) 기억 합성에 의해 유발되는 지속적인 gene-expression programme을 발견했습니다. 이는 두드러진 경험과는 별개의 과정이며, 신경 펩타이드 신호 전달, MAPK pathway, CREB-mediated gene expression, BDNF signalling 및 시냅스 형성 관련 유전자를 포함합니다.
(3) 공포 기억이 유발될 때 BLA-specific Gpr88+ neuron에서 Penk 유전자의 발현이 증가하고 Tac1 유전자의 발현이 감소하는 현상을 관찰했습니다.
(4) Engram 세포의 구조 일부를 확인했습니다. 이 세포들이 장기 기억 형성에 어떻게 기여하는지에 대한 이해를 높였습니다.
또한, 해당 연구에서는 engram 주변 astrocyte들이 지속적인 유전자 발현 변화를 보이며 이들이 ‘engram astrocyte’일 수 있음을 밝혀내고, 이들 중 하나인 Igfbp2 유전자가 장기 기억 형성에 중요하다는 것을 확인했습니다. 이 모든 발견은 단기 기억이 어떻게 장기 기억으로 전환되는지, 그리고 이 과정에서 engram 세포들이 어떻게 작용하는지에 대한 이해를 더욱 더 깊게 해 주었습니다.

![Read more about the article [Nature Genetics] Cross-ancestry genome-wide analysis of atrial fibrillation unveils disease biology and enables cardioembolic risk prediction](https://scienceeasyview.com/wp-content/uploads/2023/02/EzV-Nature-Genetics-Cross-ancestry-genome-wide-analysis-of-atrial-fibrillation-unveils-disease-biology-and-enables-cardioembolic-risk-prediction-300x239.png)