인간 신경망 모델은 ALS(근위축성 측삭 경화증)와 FTLD(전두측두엽 변성증)에서 NPTX2 병리를 밝혀냅니다.
Abstract
신경퇴행성 질환을 모델링하는 인간 세포 모델은 재현성과 지속성이 필요합니다. 이는 연령에 따라 발생하는 질병을 모사하는 데 필수적입니다. 특히, 동물 모델에서 직접 연구할 수 없는 인간 특이적 메커니즘을 포함하는 TDP-43 단백질병리학에 필요합니다. 여기서, TDP-43 병리의 출현과 결과를 탐구하기 위해, 우리는 신경 전구체의 수동 선택을 통해 유도된 다능성 줄기 세포에서 유래된, 집락 형태의 신경 줄기 세포(iCoMoNSCs)를 생성했습니다. 단일 세포 전사체학과 독립적인 신경 줄기 세포와의 비교는 iCoMoNSCs가 독특하게 균일하고 자가 갱신하는 것을 보여줍니다. 분화된 iCoMoNSCs는 시냅스로 연결되고 전기생리학적으로 활성화된 뉴런으로 구성된 자기 조직화된 다세포 시스템을 형성하며, 이는 장기간 생존하는 기능적 네트워크(iNets)로 성숙했습니다. iNets 내의 뉴런과 신경교 세포의 성숙은 대뇌 유기체와 유사했습니다. iNets 내 소수의 뉴런에서 야생형 TDP-43의 과발현은 단백질의 점진적인 분열과 응집을 초래하여 부분적인 기능 상실과 신경독성을 일으켰습니다. 단일 세포 전사체학은 TDP-43을 과발현하는 뉴런과 핵 내 TDP-43의 손실을 보이는 TDP-43 단백질병리학 환자에서 새로운 세트의 잘못 조절된 RNA 대상을 밝혀냈습니다. 가장 강력하게 조절된 대상은 시냅스 단백질 NPTX2를 인코딩하는데, 그 수준은 TDP-43이 그 3′ 비번역 영역에 결합함으로써 조절됩니다. iNets에서 NPTX2를 과발현하면 신경독성이 나타났으며, NPTX2의 잘못된 조절을 교정하면 TDP-43 유발 신경퇴행으로부터 뉴런을 부분적으로 구할 수 있었습니다. 주목할 만한 것은, NPTX2가 TDP-43 병리를 가진 근위축성 측삭 경화증과 전두측두엽 변성 환자의 뉴런에서 일관되게 잘못 축적되었다는 것입니다. 우리의 작업은 TDP-43의 잘못된 조절과 NPTX2 축적을 직접 연결시키며, 이로써 TDP-43 의존적 신경독성 경로를 밝혀냈습니다.
Background
TDP-43 단백질의 역할과 신경퇴행성 질환에서의 병리학적 매커니즘
– TDP-43 단백질은 ALS와 FTLD를 포함한 신경퇴행성 질환을 앓는 환자들의 영향받은 뉴런에 축적됩니다.
– TDP-43는 자신의 mRNA에 결합함으로써 자가 조절되는 필수 RNA 결합 단백질입니다.
– 정상 세포에서 TDP-43는 주로 핵에 위치하며 수백 개의 RNA 대상의 처리를 직접 제어합니다. 반면, 병리학적 상태에서는 신경독성을 가진 병리학적 집합체를 형성합니다.
– TDP-43의 핵 기능 손실은 STMN2와 UNC13A와 같은 인간 특이적 RNA 대상에서 은밀한(cryptic) 엑손의 포함을 포함한 광범위한 스플라이싱 오조절을 초래하며, 이는 신경퇴행과 직접적으로 연결됩니다.
– STMN2와 UNC13A에 대한 연구는 TDP-43의 key target과 이의 잘못된 조절로 인한 병리학적 메커니즘을 규명하기 위해 인간 기반의 실험 모델 개발을 촉진했습니다.
Figures
iCoMoNSCs are uniquely homogeneous
– 정상 인간 피부 섬유아세포로부터 유도된 다능성 줄기 세포를 기반으로 자가 갱신 가능한 인간 신경 줄기 세포 계열(iCoMoNSCs)을 개발함.
– CoMoNSCs는 세포 군집에서 방사형 형태와 neural stem cell(NCS) 특이적 표지자의 발현을 유지하며 안정적인 핵형을 보였음.
– 단일 세포 RNA 시퀀싱을 통해 iCoMoNSCs의 높은 균일성 확인
– 대부분의 iCoMoNSCs 세포가 진정한 자가 갱신 NSC임을 보여주며, 소수의 세포에서 저분화 상태를 나타냄.
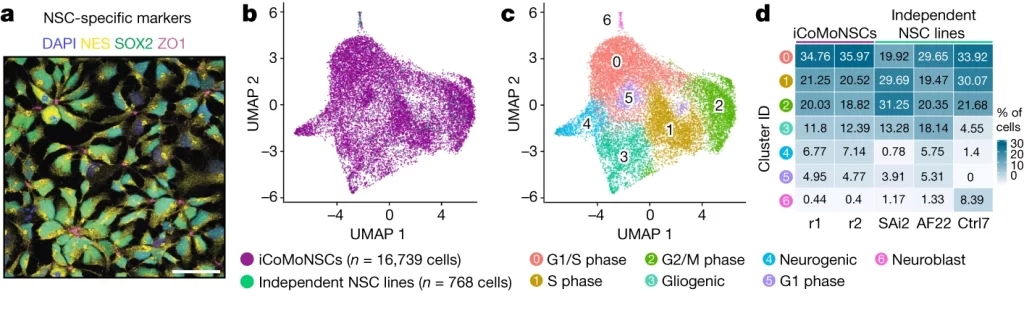
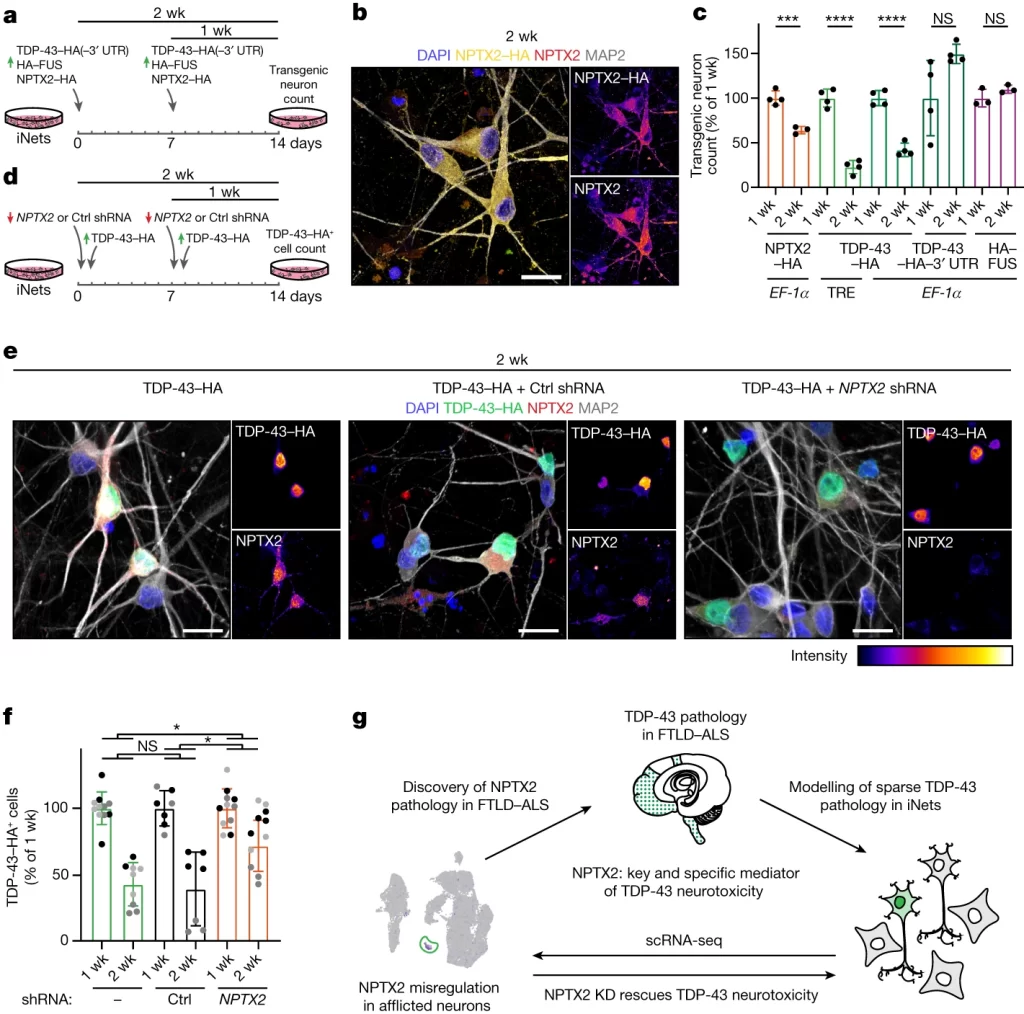
Fig. 1. iCoMoNSC 뉴런은 기능적 네트워크를 형성합니다.
(A) iCoMoNSCs에서 NSC 마커의 면역 형광 검출
(B,C) 세 개의 독립적인 NSC 라인에서 유래한 세포와 통합된 iCoMoNSCs의 UMAP plot
(D) 클러스터별 샘플당 세포 분포 비율. r1과 r2는 각각 복제 1과 2를 나타냄.
[Fig 1D] iCoMoNSCs와 iPS 세포에서 유래된 AF22 및 Ctrl7 라인은 매우 유사한 세포 분포를 보였으나, 인간 태아 뒷뇌 기본 NSC에서 유래된 SAi2 라인은 약간 다른 세포 주기 분포를 보였습니다. 그럼에도 불구하고, 독립적인 NSC 라인과의 유사성에도 불구하고, iCoMoNSCs는 주로 자가 갱신 NSC로 구성되어 있음을 나타내는 클러스터 6에 표시된 확약된 신경아세포가 훨씬 적었습니다(3배에서 20배 적음)
iCoMoNSC neurons form functional networks
– iCoMoNSCs는 분화를 통해 뉴런과 신경교 세포의 혼합 다층 배양을 생성하며, 이 과정에서 NEUN+ 뉴런 비율이 점차 증가
– 시냅스 마커의 면역 염색과 전자 현미경 검사를 통해 시냅스 구조가 특징적으로 나타나며, 이는 신경 세포 간의 연결을 시각적으로 확인할 수 있음
– 칼슘 영상과 전기생리학적 측정 결과, iCoMoNSC 유래 뉴런이 활성화되어 있음을 확인하며, 이는 신경 세포의 기능적인 상호작용을 나타냄
– 고밀도 마이크로전극 배열을 사용한 연구는 신경망의 성숙과 기능적 연결의 발달을 보여주며, 이는 시간이 지남에 따라 증가하는 신경 세포의 성숙과 활동성을 시사함
Fig. 1. iCoMoNSC 뉴런은 기능적 네트워크를 형성합니다.
(E-H) 1.5개월 된 인간 신경 배양체에 뉴런(e) 또는 성상교세포(f) 마커로 염색한 면역 형광. 3개월에 SYP(g) 및 SNAP-25(h)의 시냅스 마커 면역 형광
(I,J) (i) SNS의 전자 현미경 검사로 전- 및 후시냅스 구획을 보여줍니다. (j) SNS 분획의 웨스턴 블롯
(K) Population spike time histograms(상단) raster plot(하단)
(L,M) 네트워크(l) 또는 단일 세포 및 세포 하(m) 지표의 백분율 변화에 대한 히트맵.
(N) HD-MEA(고밀도 마이크로전극 배열) 전기 이미지 또는 ‘발자국’은 젊은(상단), 중간 단계(중앙), 그리고 노화된(하단) 배양체에서 세 개의 뉴런의 활동 전위 진폭(전압) 측면에서 전기 활동의 2차원 공간 분포 지도
[Fig 1I,J] 전자 현미경을 사용한 신경아세포체(synaptoneurosomes, SNS) 검사는 시냅스의 전- 및 후- 구획을 상세하게 보여주며, SNS 분획에 대한 웨스턴 블롯 분석은 이러한 시냅스 구조물의 단백질 구성을 확인합니다. SNS는 시냅스 기능을 연구하기 위해 사용되는 미세 구조물로, 신경전달 물질의 방출과 수용체 활동 같은 시냅스 기능을 제어된 환경에서 연구할 수 있게 해줍니다.
[Fig 1K-M] 젊은 신경 배양체는 중간 및 성숙한 단계의 배양체에 비해 활동성이 낮았으며, 이는 시간이 지남에 따라 시냅스 연결의 발달과 함께 버스트 활동의 빈도와 질이 개선됨을 나타냅니다. 초기 단계에서는 불규칙한 버스트 활동이 관찰되었으나, 성숙한 배양체에서는 더 높은 수준의 활동성과 규칙적인 신경 활동이 감지되었습니다, 이는 신경망의 성숙과 기능적 연결의 발달을 시사합니다.
iNets transcriptionally mimic organoids
– 젊은, 중간, 노화된 iNets에서 실시한 scRNA-seq을 통해 뉴런, 성상교세포, 기타 신경교 세포 등 19개 세포 클러스터를 식별했습니다.
– 성숙도는 시간이 지남에 따라 증가하며, 특히 뉴런과 성상교세포 클러스터에서 뚜렷하게 나타났습니다.
– iNets의 세포들이 뇌 오가노이드와 유사한 전사적 성숙도를 보여, 이 모델이 신경과 신경교 세포의 발달 과정을 잘 반영함을 시사합니다.
– 비록 3D 구조는 없지만, iNets의 신경과 신경교 세포는 뇌 오가노이드와 유사한 유전자 발현 패턴을 보였습니다.
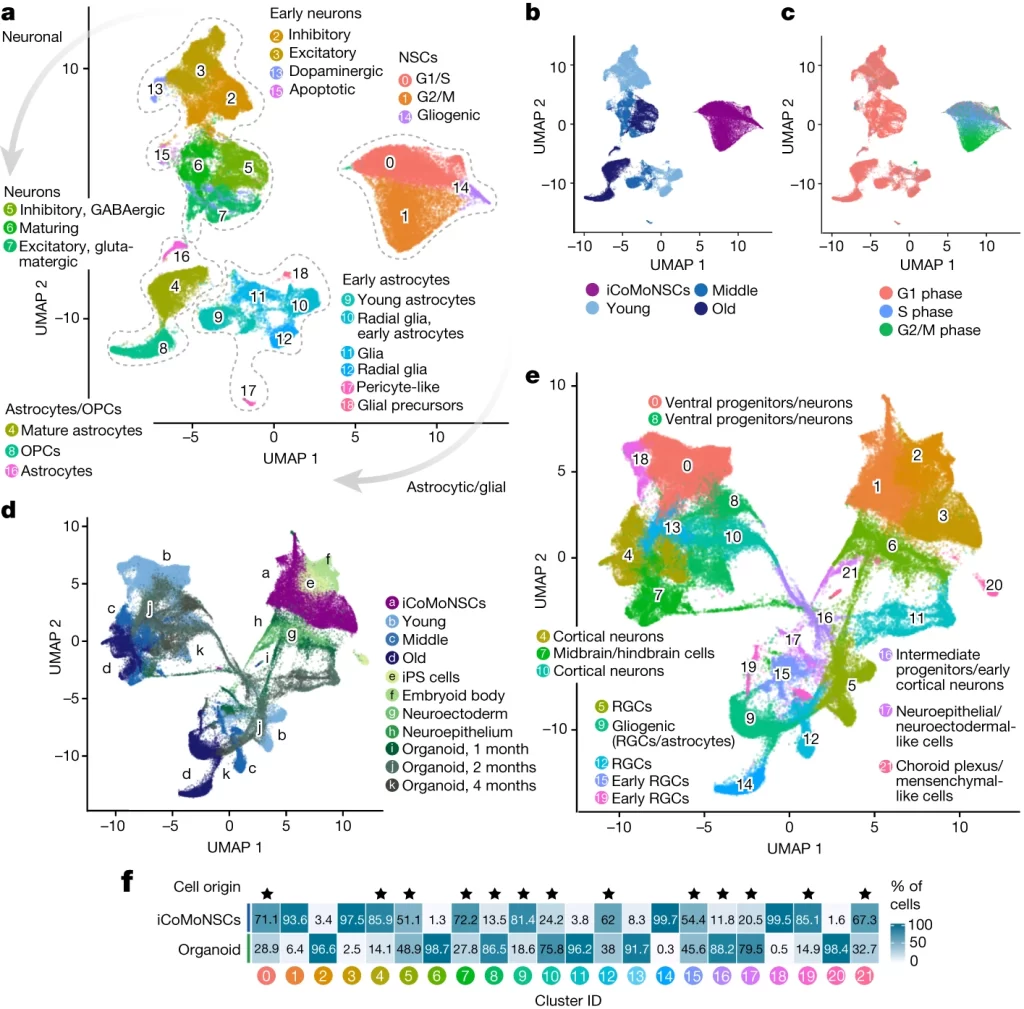
Fig. 2. iNets은 부분적으로 brain organoids를 모사합니다.
(A) UMAP 분석은 젊은, 중간 단계, 그리고 노화된 iCoMoNSC에서 유래된 iNets의 다양한 세포 클러스터를 시각화합니다. 각 클러스터는 수동으로 주석이 달린 색상으로 강조되며, 회색 화살표는 모든 샘플에 걸쳐 뉴런, 성상교세포, 또는 신경교 세포의 점진적인 성숙 방향을 나타냅니다.
(B-C) UMAP 데이터는 annotated 된 (b) 또는 예측된세포 주기(c) 단계에 따라 주석 처리
(D-E) 오가노이드 데이터셋과 통합된 UMAP 데이터. 실험 단계의 기원(d)을 강조하거나 iCoMoNSC와 오가노이드 세포 모두를 포함하는 클러스터(e)
(F) 모든 클러스터에 걸친 셀 분포. *은 기원당 cell orgin이 모두 10% 이상인 클러스터
[Fig. 2A-C] 뉴런과 성상교세포 클러스터는 분화 과정에서 시간에 따라 성숙도가 증가하는 경향을 보였으며, 이는 모든 실험적 또는 예측된 세포 주기 단계의 시각화를 통해 명확히 확인할 수 있었습니다.
[Fig. 2D-F] iNets 내에서 나타나는 세포 유형의 성숙도 수준을 결정하기 위해, 우리는 두 개의 뇌 오가노이드에 대한 scRNA-seq 데이터 세트와 우리의 데이터를 통합하여 22개의 클러스터를 식별했습니다. 두 데이터 세트에서 유래한 세포들은 대부분의 클러스터에서 혼합되었으나, 전반적으로 다양한 발달 단계를 나타낼 수 있는 세포 유형 내의 전사체 차이를 시사하는 다른 부분을 차지했습니다. 대부분의 클러스터에는 iNets와 오가노이드 양쪽 시스템에서 유래한 세포들이 포함되어 있었습니다, 이는 iNets가 뇌 오가노이드와 유사한 전사적 성숙도 수준을 가진 신경 및 신경교 세포를 포함하고 있음을 시사합니다.
Sparse TDP-43 pathology in iNets
– TDP-43–HA 과발현은 인간 뉴런에 독성을 나타내며 시간이 지남에 따라 전이성 뉴런의 비율이 점차 감소합니다.
– TDP-43–HA는 SarkoSpin 방법을 통해 진행성 aggregated, fragmented 된 밴드의 출현을 보여, TDP-43 단백질병리학 환자의 뇌와 유사한 집합체 형성을 시사합니다.
– iNets에서 TDP-43–HA의 sparse한 과발현과 관련된 병리학은 초기에 영향을 받은 세포를 넘어 확장되며, TDP-43 변화는 시간이 지남에 따라 비전이성 뉴런에서도 나타납니다.
– scRNA-seq 분석은 TDP-43–HA 과발현 세포들이 특정 클러스터에 집중되어 있음을 밝히며, 이러한 세포에서 TDP-43–HA의 상승된 발현과 함께 여러 유전자의 발현 변화를 확인합니다.
– 특정 단백질, 예를 들어 NPTX2는 TDP-43에 의해 직접 결합되는 RNA 대상이며, 이는 모델의 인간 질병에 대한 관련성을 검증합니다.
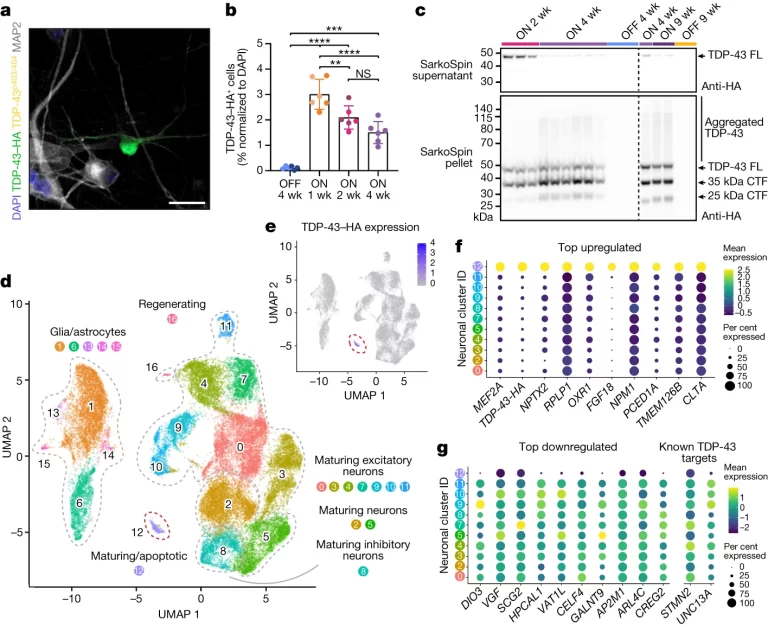
Fig. 3. TDP-43 병리가 유도된 iNet 뉴런의 전사체 프로파일
(A) iNet 뉴런에서 TDP-43-HA의 면역형광
(B) 시간 경과에 따른 TDP-43-HA 양성 뉴런의 정량화
(C) SarkoSpin 상층액(위) 및 펠릿(아래)의 웨스턴 블롯
(D-E) scRNA-seq TDP-43 과발현 실험의 UMAP
(F-G) 다른 클러스터와 비교하여 클러스터 12에서 상위 10개 상향 조절(f) 및 하향 조절 마커 유전자와 두 개의 알려진 TDP-43 표적(g)의 확장된 평균 발현을 표시한 dot 플롯
[Fig. 3A-B] TDP-43 병리는 TDP-43 단백질병리를 가진 환자의 뇌 영역에 영향을 미치며, FTLD에서는 2% 미만의 대뇌 피질 세포에서 TDP-43의 병리학적 변화가 나타납니다. 이를 모방하기 위해, 연구진은 젊은 iNets에 인간 TDP-43을 발현하는 렌티바이러스 벡터를 2% 정도의 세포에 전달하여, TDP-43–HA의 과발현이 인간 뉴런에 독성을 나타내며 시간이 지남에 따라 전이성 뉴런의 비율이 감소하는 것을 관찰했습니다.
[Fig. 3C] 연구팀은 TDP-43 병리를 모방하기 위해 젊은 iNets에 TDP-43–HA를 과발현시키는 렌티바이러스 벡터를 사용했습니다. 이 과정에서 TDP-43–HA의 과발현이 인간 뉴런에 독성을 나타내며, TDP-43–HA가 집적되고 단편화되어 세포 손실을 초래하는 것을 관찰했습니다.
[Fig. 3D-G] 이 분석은 TDP-43–HA 과발현 세포들이 주로 구성된 클러스터 12를 확인했습니다. 이 클러스터에서 TDP-43–HA의 증가된 표현과 특정 유전자(STMN2, UNC13A)의 발현 변화가 관찰되었으며, 이는 TDP-43이 직접 결합하는 RNA 목표들과 관련이 있습니다. 또한, NPTX2 같은 신경 특이적 단백질의 역할을 포함하는 여러 마커 유전자가 변화하였습니다. 이 연구는 TDP-43과 관련된 병리학적 변화가 인간 질병 모델링에 중요함을 보여주며, FTLD 환자의 뇌에서의 TDP-43 결합 패턴 변화를 통해 이를 더 확인했습니다.
TDP-43 regulates NPTX2 via 3′ UTR binding
– 연구팀은 ALS 및 FTLD 환자의 뇌 샘플에서 클러스터 12 마커 유전자의 발현이 변화하는지 조사했습니다. 특히, NPTX2 mRNA는 FTLD–ALS 환자에서 두 배 증가했습니다.
– TDP-43는 NPTX2 mRNA에 직접 결합하며, 이 결합은 FTLD 환자의 뇌에서 감소했습니다. 이는 TDP-43 병리가 있는 인간 뉴런에서 변화하는 인간 특이적 사건입니다.
– TDP-43는 대상 유전자의 3′ UTR 결합을 통해 mRNA 수준을 감소시키는 것으로 알려져 있습니다. 실험에서 TDP-43의 NPTX2에 대한 결합이 유사한 영향을 미침을 확인했습니다.
– TDP-43 결핍을 TDP-43–HA 과발현으로 구제할 수 있었으며, 이는 TDP-43의 RNA 결합 기능이 NPTX2 mRNA 조절에 필수적임을 보여줍니다.
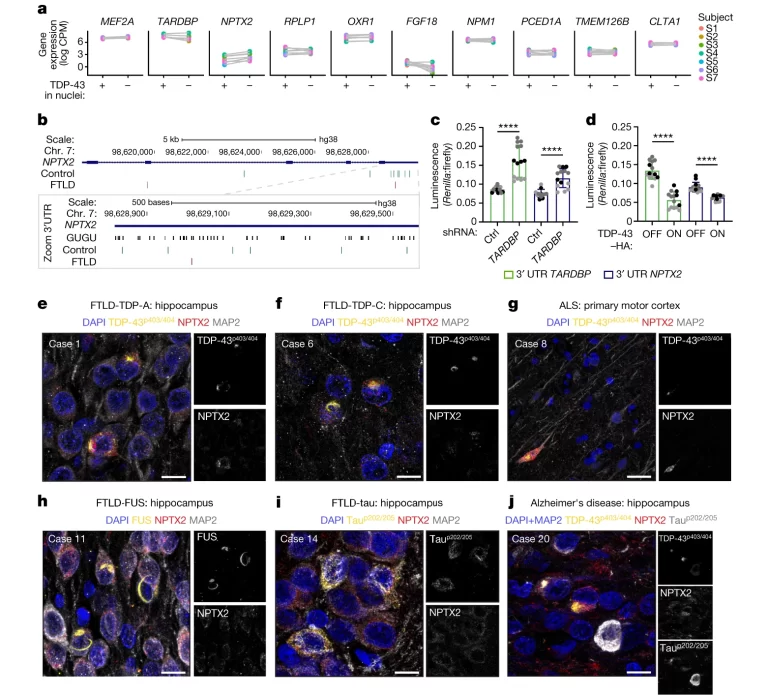
Fig. 4. NPTX2의 3′ UTR에 결합하는 TDP-43의 손실은 TDP-43 단백질병증 환자의 뇌에 TDP-43의 비정상적인 축적을 초래합니다.
(A) FTLD-ALS 환자의 일치하는 TDP-43 음성 및 TDP-43 양성 신경 핵에서 클러스터 12에서 상향 조절되는 상위 10개 마커 유전자의 유전자 발현(CPM)
(B) 대조군(녹색) 및 FTLD 환자(빨간색) 인간 두뇌의 NPTX2에 있는 iCLIP crosslink의 위치(상단). NPTX2 3′ UTR에서 iCLIP crosslink 및 GUGU repeats의 확대(하단)
(C-D) 이중 발광 분석은 TDP-43 녹다운(c) 및 TDP-43-HA 과발현(d) 시 TARDBP 및 NPTX2 3’UTR 리포터의 유사한 동작을 보여주었습니다.
(E-J)Immunofluorescence of human brain sections.
[Fig 4A] 연구팀은 ALS 및 FTLD 환자의 뇌 샘플에서 클러스터 12의 새롭게 식별된 마커 유전자의 발현이 변화하는지 조사했습니다. RNA-시퀀싱 데이터셋을 재분석하여, TDP-43이 부재하는 뉴런에서 NPTX2 mRNA가 가장 강하게 증가했으며, 이는 FTLD–ALS 환자에서 대조군에 비해 두 배 증가한 것으로 나타났습니다. 이는 TDP-43 병리가 있는 환자들에서 특정 유전자의 발현 변화를 보여주며, 특히 NPTX2의 역할에 대한 중요한 통찰을 제공합니다.
[Fig 4B] iCLIP 데이터 분석에 따르면, TDP-43는 NPTX2 mRNA에 직접 결합하며, 특히 GU가 풍부한 지역 내 3′ 비번역 영역(UTR)에서 주로 발생합니다. 중요한 것은, FTLD 환자의 뇌에서 이 TDP-43–NPTX2 상호작용이 감소했다는 것이 iCLIP 크로스링크의 손실을 통해 나타났습니다. 이는 직접적인 단백질-RNA 상호작용의 위치를 표시합니다.
[Fig 4C,D] 연구에서는 TDP-43가 대상 유전자의 3′ UTR에 결합할 때, 해당 대상의 mRNA 수준을 감소시키는 것을 보여줍니다. 이는 TDP-43의 자가조절 경로를 매개하는 메커니즘입니다. TDP-43가 NPTX2에 같은 영향을 미치는지 확인하기 위해, 연구팀은 HEK293T 세포에 TDP-43의 결합 실험을 수행했습니다. TDP-43의 감소는 NPTX2 mRNA의 수준을 증가시켰으나, TDP-43–HA의 과발현은 반대 효과를 나타냈습니다. 이는 TDP-43의 RNA 결합 기능이 NPTX2 mRNA의 조절에 필수적임을 시사합니다.
[Fig 4E-J]다양한 신경퇴행성 질환을 가진 환자들의 뇌에서 신경 가소성과 시냅스 기능에 중요한 역할을 하는 NPTX2 단백질의 축적을 조사하고, 이것이 TDP-43 병리학과 어떤 관련이 있는지 평가합니다.
Lowering NPTX2 rescues TDP-43 toxicity
– iNets에서 NPTX2–HA를 과발현시키면, 세포질과 신경돌기에 NPTX2가 축적되었으며, 이는 TDP-43–HA 양성 뉴런에서 관찰된 NPTX2 축적 패턴을 모방합니다.
– NPTX2–HA의 직접적인 과발현은 HA–FUS의 과발현과 달리 신경독성을 유발하였습니다.
– TDP-43–HA의 과발현은 시간이 지남에 따라 변형된 뉴런의 가장 큰 손실을 초래하였고, TDP-43–HA에 의한 신경독성은 NPTX2–HA에 의한 것보다 더 심각하였습니다.
– NPTX2를 표적으로 하는 shRNAs를 사용하여 NPTX2 수준을 낮추는 실험을 통해, TDP-43–HA의 과발현으로 인한 신경독성을 제거하는 효과를 관찰하였습니다.
– NPTX2 수준의 교정은 TDP-43 단백질병리에 대한 치료 전략으로서의 잠재력을 보여줍니다. NPTX2 수준을 낮추는 것이 TDP-43 유발 신경독성에서 세포를 구조하는데 유의미하지만 부분적인 효과를 보였습니다.
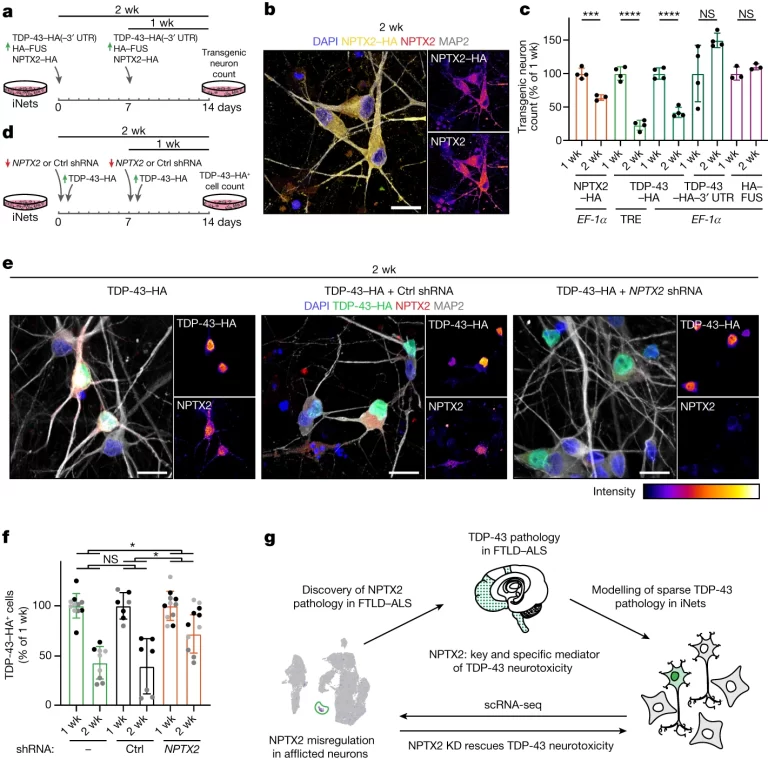
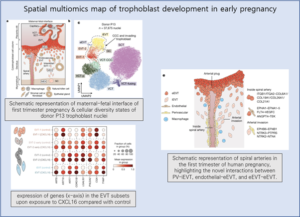
Fig. 5. NPTX2의 독성 수준을 교정함으로써 TDP-43 유발 신경퇴화를 막는다.
(A) (b)와 (c)에 대한 실험 설계 Timeline
(B) 2주 후 NPTX2-HA를 과발현하는 iNet 뉴런에서의 HA 태그 및 NPTX2 면역형광
(C) 형질전환 뉴런의 정량화.
(D) (e)-(g)에 대한 실험 설계 Timeline
(E) 2주 후, Ctrl 또는 NPTX2 shRNA 처리 유무에 따라 TDP-43-HA를 발현하는 iNets의 면역형광.
(F) TDP-43-HA 형질전환 세포의 정량화
(G) 실험 overview
[Fig 5A-C] NPTX2 과발현의 신경독성 효과
목적: NPTX2–HA의 과발현이 신경 세포 생존에 미치는 영향을 조사하기 위해, iNets에서 NPTX2–HA를 과발현시킨 후 생존하는 변형 신경 세포의 수를 TDP-43–HA를 과발현시킨 iNets와 비교합니다.
발견: NPTX2–HA의 과발현은 세포질과 신경돌기에서의 NPTX2 축적을 초래하며, 이는 TDP-43–HA 양성 뉴런에서 관찰된 NPTX2 축적 패턴을 모방합니다. NPTX2–HA의 직접적인 과발현은 신경독성을 유발했으며, TDP-43–HA 수준과 변형 신경 세포의 비율 사이에는 유의한 양의 상관관계가 있었습니다.
특이 사항: TDP-43–HA의 과발현은 시간이 지남에 따라 변형된 신경 세포의 가장 큰 손실을 초래했습니다. 이러한 손실은 유도 가능한 TRE 프로모터에 의해 주도되었으며, EF-1α 프로모터에 의한 지속적인 과발현은 덜 심각한 신경독성을 유발했습니다. TDP-43–HA의 3′ UTR에 의한 수준 제한은 이 시간 프레임에서 독성이 없었습니다.
[Fig 5D-G] NPTX2 수준 교정을 통한 신경 세포 구조
목적: NPTX2 수준의 증가가 신경 세포에 미치는 독성 효과를 완화시킬 수 있는지 조사하기 위해, TDP-43–HA의 과발현을 유도하기 전날 NPTX2를 표적으로 하는 shRNA를 처리하여 NPTX2 수준을 낮춥니다.
발견: 선택된 shRNA 처리는 TDP-43–HA를 과발현하는 iNets에서 NPTX2 수준을 현저히 감소시켰습니다. 이는 웨스턴 블롯과 면역형광 분석을 통해 확인되었습니다. NPTX2 shRNA 처리는 TDP-43 유발 신경독성에서 세포를 부분적으로 구조하는 데 효과적이었습니다.
특이 사항: 한 쌍의 NPTX2 shRNA 중 하나는 통계적으로 유의미한 효과를 보이지 않았으나, 다른 하나는 TDP-43 유발 신경독성에서 세포를 구조하는 데 유의미한 효과를 보였습니다. 이 구조 효과는 중요하지만 부분적이었습니다.
Disscussion
이 연구는 장기간 자가갱신이 가능한 신경줄기세포(NSC)를 이용하여 신경발생과 중추신경계(CNS) 관련 질환 모델을 생성하고, 특히 TDP-43의 과발현이 신경 세포에 미치는 영향을 탐구합니다. 연구팀은 배아줄기세포나 유도만능줄기세포(iPS 세포)로부터 유래한 NSC 계통을 활용하여, iCoMoNSCs라 명명된 균일한 자가갱신 NSC 집단을 생성했습니다. 이 NSC들은 성숙하고 다양한 신경 및 교세포 하위 유형으로 분화할 잠재력을 가지고 있음이 밝혀졌습니다. 특히, iCoMoNSCs는 일관되게 혼합된 신경과 교세포 cultures를 형성하여, 전기생리학적으로 활성화된 뉴런들로 이루어진 상호연결된 네트워크인 iNets를 생성했습니다. 이 iNets는 인간 뇌 오가노이드와 유사한 신경과 교세포 하위 유형의 점진적인 성숙을 보여주었습니다.
연구팀은 TDP-43의 과발현이 시간이 지남에 따라 iNets에 미치는 영향을 조사했습니다. 이는 실제 질병 상태에서 단지 소수의 세포만이 TDP-43 병리를 포함한다는 사실을 모방하는 시도였습니다. TDP-43-HA의 과발현 후, 연구팀은 TDP-43-HA 수준의 감소와 함께 불용성 TDP-43의 점진적인 집합 및 C말단 분열을 관찰했습니다. 또한, scRNA-seq 분석을 통해 TDP-43 과발현 및 병리를 가진 세포들이 STMN2와 UNC13A의 다운레귤레이션을 나타내는 독특한 전사 프로파일을 가지고 있음을 밝혀냈습니다.
이 연구는 또한 NPTX2 단백질의 이상적인 축적이 TDP-43 미스레귤레이션의 직접적인 결과임을 확인했습니다. NPTX2의 축적은 FTLD-FUS나 FTLD-tau와 같은 다른 단백질병리와는 관련이 없었으며, TDP-43 오조절과의 특정 연관성을 제안했습니다. 연구팀은 NPTX2의 직접적인 과발현이 iNets에서 신경독성을 유발한다는 것을 발견했으며, 이는 TDP-43 유발 독성과 비교했을 때 더 약했습니다. 이는 NPTX2가 TDP-43 독성의 매개체 중 하나일 수 있음을 제안합니다. 연구팀은 NPTX2 수준을 shRNA로 조정함으로써 iNets 뉴런의 TDP-43 신경독성을 상당히 구제할 수 있음을 발견했습니다.
이 연구는 TDP-43의 주요 뉴런 대상으로서 NPTX2를 확인하고, 영향을 받은 뉴런에서의 그것의 이상적인 증가가 FTLD–ALS에서 뉴런 손실로 이어지는 병리학적 연쇄작용을 촉발할 수 있음을 제안합니다. NPTX2는 STMN2와 UNC13A와 함께 TDP-43 단백질병에 대한 중요한 치료 대상일 수 있습니다. 이러한 발견은 TDP-43 관련 신경퇴행성 질환의 이해와 치료 전략 개발에 중요한 기여를 합니다