Orphan quailty control의 동적 네트워크와 유전자 발현 조절
Abstract
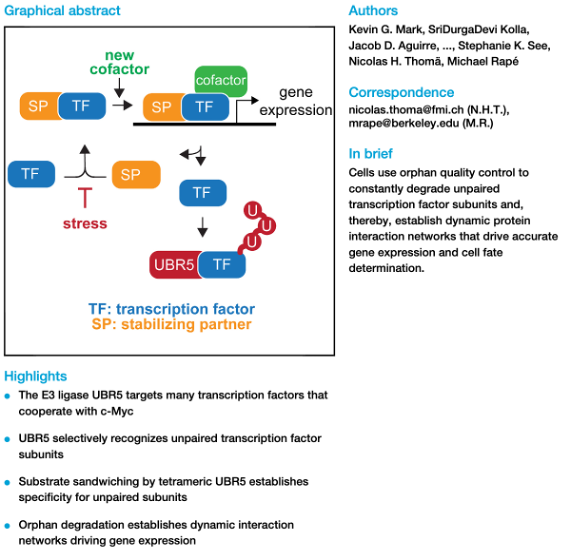
모든 진핵생물은 발달 신호(developmental signals)를 세포 운명 결정(cell fate decisions)으로 정확하게 전환하기 위해 복잡한 단백질 네트워크를 필요로 합니다. 네트워크 구성요소 간 상호작용을 방해하는 돌연변이는 종종 질병을 초래하지만, 복잡한 네트워크의 구성과 동적 특성이 어떻게 결정되는지는 아직 잘 이해되지 않았습니다. 본 연구에서, 우리는 E3 ligase인 UBR5가 c-Myc oncoprotein을 중심으로 하는 네트워크의 여러 전사 조절자의 unpaired subunit들을 분해하는데 도움을 주는 신호 중심체(signalling hub)임을 식별했습니다. 생화학적 및 구조적 분석을 통해 UBR5가 결합하는 모티프는 단백질이 복합체를 이루지 않고 분리되어 있을 때(orphan 상태)만 인식 가능하다는 것을 확인하였습니다. UBR5는 다른 단백질과 결합되지 않은 전사 인자 subunits를 빠르게 교체함으로써, 세포들이 유전자 발현을 효과적으로 수행할 수 있도록 하며 새로운 환경 신호를 수용할 수 있도록 전사 조절자들 간의 동적 상호작용을 조절합니다. 우리는 orphan quaility control (복합체를 이루지 않는 단백질을 분해하여 quaility control를 한다는 의미)가 동적 단백질 네트워크를 구축하는데 필수적인 역할을 하는 것으로 결론지었습니다. 이를 통해 전사 과정 중 단백질 분해의 보편적 필요성을 제시하였으며, 질병에서 유전자 발현을 조절할 수 있는 가능성을 제시합니다.