cDC1의 SLC38A2 및 glutamine signalling이 anti-tumour immunity 결정합니다.
Abstract
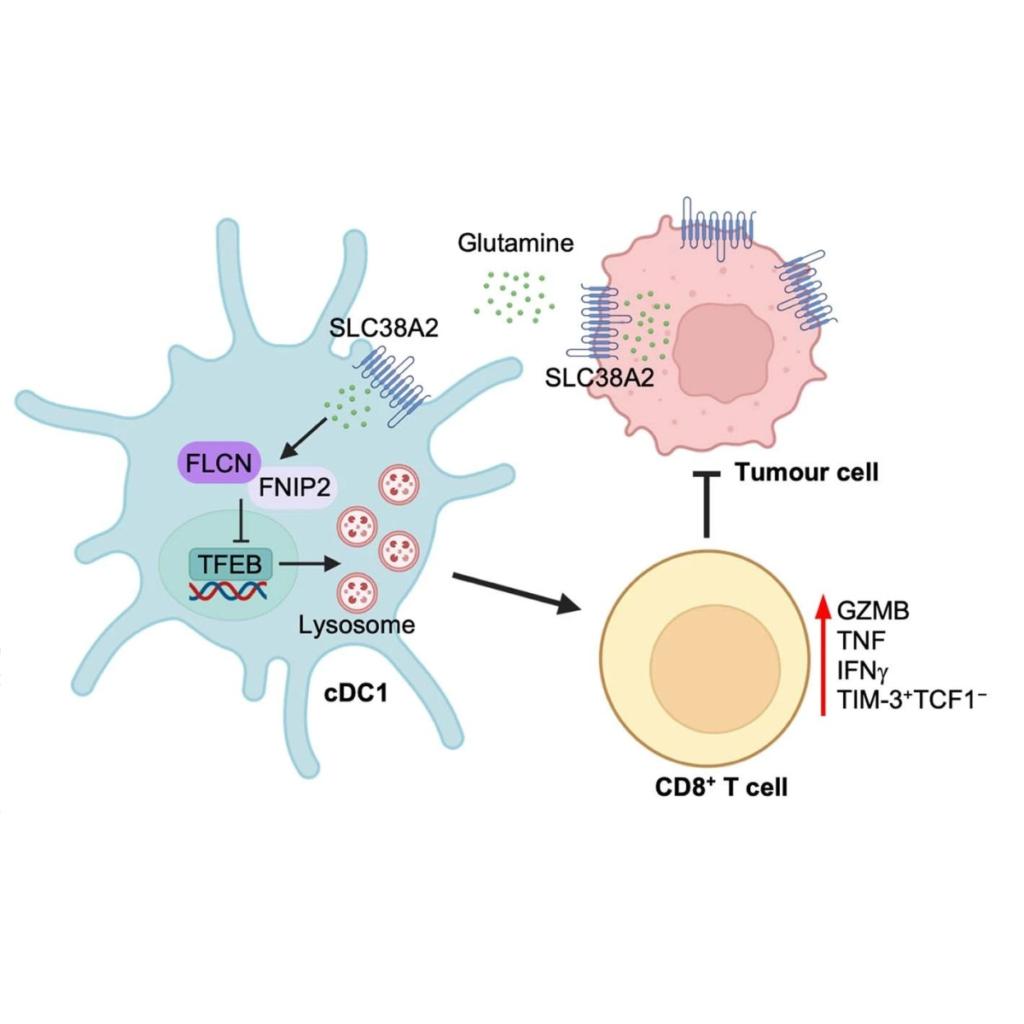
Cancer cells은 그 메커니즘이 잘 알려져 있지 않은 tumour–immune interactions을 통해 T cell-mediated killing을 회피합니다. Dendritic cells (DC), 특히 type-1 conventional DCs (cDC1)는 tumours에 대한 T cell priming과 치료 효능을 매개합니다. DC 기능은 pattern recognition receptors에 의해 조율되지만 관련된 다른 신호는 아직 불완전하게 정의되어 있습니다. 영양소가 adaptive immunity의 새로운 매개체로 떠오르고 있지만 영양소가 DC 기능이나 innate and adaptive immune cells 간의 통신에 영향을 미치는지 여부는 대부분 밝혀지지 않았습니다. 본 연구에서는 glutamine을 tumour–cDC1 crosstalk을 지시하고 cytotoxic T cells을 활성화하는 cDC1 기능을 허가하는 intercellular metabolic checkpoint로 설정했습니다. Intratumoral glutamine supplementation은 cDC1-mediated CD8+ T cell immunity를 강화하여 tumour growth를 억제하고 checkpoint blockade and T cell-mediated immunotherapies에 대한 치료 저항성을 극복합니다. 기계적으로 tumour cells과 cDC1은 transporter SLC38A2를 통해 glutamine uptake를 놓고 경쟁하여 anti-tumour immunity를 조정합니다. Nutrient screening and integrative analyses에 따르면 glutamine은 cDC1 기능을 촉진하는 주요 아미노산입니다. 또한, FLCN을 통한 glutamine signalling은 TFEB 기능에 영향을 미칩니다. DC에서 FLCN의 loss는 TFEB-dependent manner로 in vivo cDC1 기능을 선택적으로 손상시키고 glutamine supplementation의 anti-tumour therapeutic effect를 제거하여 SLC38A2 deficiency를 phenocopies합니다. 우리의 연구 결과는 tumour immune evasion을 뒷받침하는 tumour cells과 cDC1 사이의 glutamine-mediated intercellular metabolic crosstalk을 확립하고 DC 활성화 및 암 치료를 위한 putative targets에 대한 제한 사건으로서 cDC1의 glutamine acquisition and signalling을 밝힙니다.
