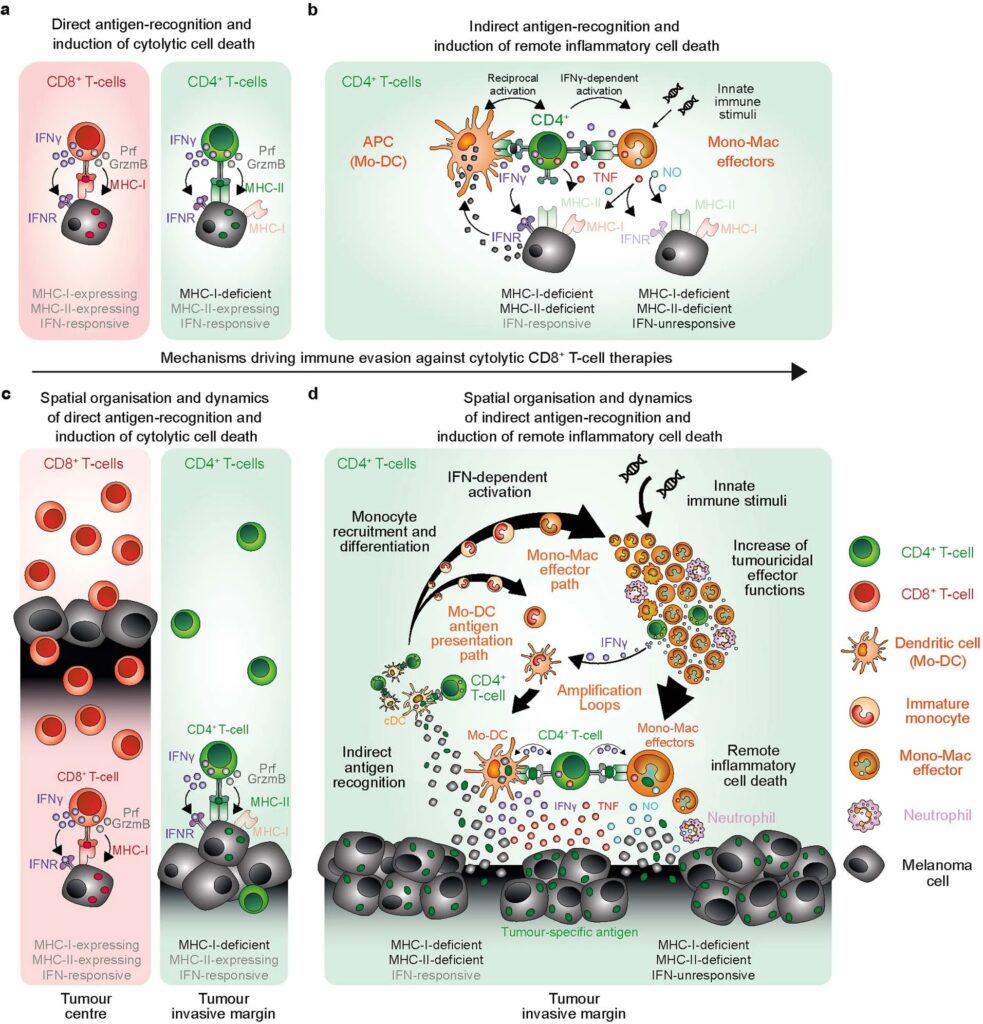
CD4+ T cell에 의한 inflammatory cell death가 immune-evasive tumours를 제어합니다.
Abstract
임상적으로 적용되는 대부분의 cancer immunotherapies은 tumour cells를 직접 인식하고 죽이는 CD8+ cytolytic T cells의 능력에 의존합니다. 이러한 전략은 주요 major histocompatibility complex (MHC) -deficient tumour cells의 출현과 immunosuppressive tumour microenvironment의 형성으로 인해 제한됩니다. CD4+ effector cells이 CD8+ T cells와 독립적으로 antitumour immunity에 기여하는 능력이 점점 더 많이 인식되고 있지만, 잠재력을 최대한 발휘할 수 있는 전략은 아직 밝혀지지 않았습니다. 여기에서는 소수의 CD4+ T cells만으로도 CD8+ T cells의 직접적인 표적을 피하는 MHC-deficient tumours을 박멸할 수 있는 메커니즘에 대해 설명합니다. CD4+ effector T cells는 tumour invasive margins에 우선적으로 모여 MHC-II+CD11c+ antigen-presenting cells과 상호 작용합니다. 우리는 T helper type 1 cell-directed CD4+ T cells와 innate immune stimulation이 tumour-associated myeloid cell network를 interferon-activated antigen-presenting and iNOS-expressing tumouricidal effector phenotypes으로 reprogramme 함을 보여줍니다. CD4+ T cells and tumouricidal myeloid cells는 함께 interferon-unresponsive and MHC-deficient tumours을 간접적으로 박멸하는 remote inflammatory cell death를 유도하는 조율을 합니다. 이러한 결과는 CD8+ T cells와 natural killer cells의 direct cytolytic activity을 보완하고 cancer immunotherapies를 발전시키기 위한 전략에서 CD4+ T cells와 innate immune stimulators의 이러한 능력을 임상적으로 활용해야 함을 보증합니다.
Figure
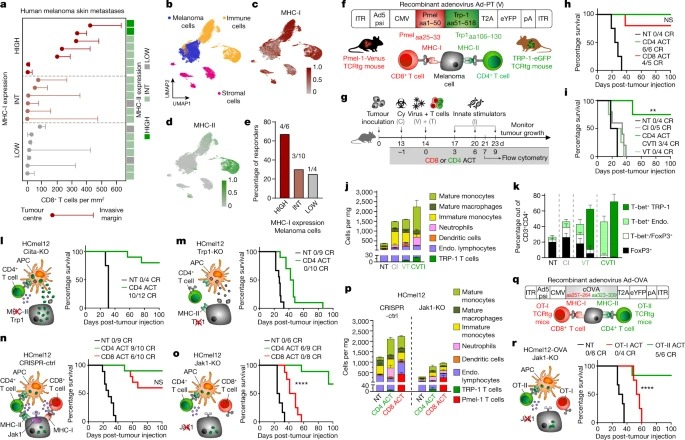
Fig. 1: 소량의 CD4+ effector T cells는 CD8+ cytotoxic T cells에 의한 파괴에 저항하는 MHC-deficient and IFN-unresponsive melanomas을 박멸할 수 있습니다.
a, 20개 human melanoma skin metastases의 tumour centre and the invasive margin에 침윤하는 CD8+ T cells의 Density 및 해당 MHC-I 및 MHC-II expression을 high, intermediate (int) 및 low expression으로 분류한 값입니다.
b, melanoma, immune and stromal cell phenotypes에 대해 주석이 달린 피부(n = 5), 피하(n = 4) 및 림프절(n = 11)의 추가 melanoma metastases 20개 세트의 single-cell transcriptomes UMAP.
C,d single melanoma cells.에서 MHC-I(c) 및 MHC-II(d) gene set expression.
e, melanoma cells에서 MHC-I 발현이 높은 환자, 중간 환자 및 낮은 환자에서 ICB therapy responders.
f, recombinant adenovirus Ad-PT의 구조.
g, 마우스에서 확립된 tumours의 Experimental protocol for ACT immunotherapy 및 time point for flow cytometric analyses.
h,i, 확립된 B16 melanomas을 보유한 생쥐의 Kaplan–Meier survival curves로, CD4 ACT 또는 CD8 ACT로 치료(h) 또는 CD4 ACT 프로토콜의 표시된 구성 요소로 치료(i)했습니다.
j,k, 표시된 대로 처리된 tumour에서 Immune cell composition (j) 및 endogenous and transferred CD4+ T cells의 phenotype (k).
l-o, Ciita-KO(l), Trp1-KO(m), CRISPR-ctrl(n) 또는 Jak1-KO(o) melanomas를 보유하고 표시된 대로 치료한 마우스의 immune cell interaction phenotypes (왼쪽) 및 Kaplan–Meier survival curves (오른쪽)의 Graphical representation.
p, 표시된 대로 처리된 tumours의 Immune cell composition.
Q, recombinant adenovirus Ad-OVA의 구조.
r, 표시된 대로 치료한 melanomas가 확립된 마우스의 ovalbumin-expressing HCmel12 Jak1-KO cells (왼쪽)와 Kaplan–Meier survival curves (오른쪽)의 immune cell interaction phenotype의 Graphical representation.
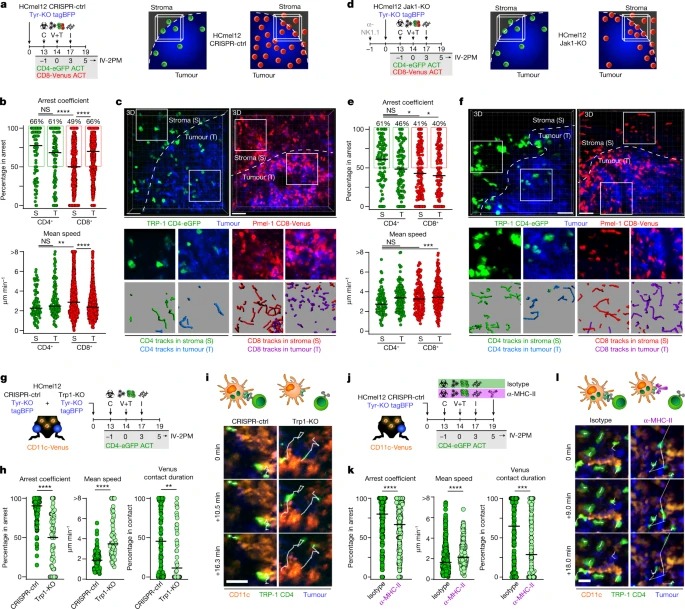
Fig. 2: CD4+ effector T cells은 invasive tumour margin 내 클러스터에서 MHC-II-expressing CD11c+ antigen-presenting cells와 상호작용합니다.
a,d, adoptively transferred T cells의 분포를 평가하기 위한 실험 프로토콜(왼쪽)과 CRISPR-ctrl(a) 또는 Jak1-KO(d) tumours의 invasive tumour margin (오른쪽)을 나타내는 그래픽.
b,e, invasive margin에서 stromal (S) 및 tumoural (T) compartment의 CRISPR-ctrl(b) 또는 Jak1-KO(e) tumours에서 채택적으로 전달된 Venus+ Pmel-1 CD8+(빨간색) 및 eGFP+ TRP-1 CD4+ T cells(녹색)의 Arrest coefficient 및 mean speed.
c,f, Representative intravital microscopic images 및 insets, CRISPR-ctrl(c) 또는 Jak1-KO(f) melanomas의 invasive tumour margin의 stromal (S) 및 tumoural (T) 영역에서 Venus+ Pmel-1 CD8+ 및 eGFP+ TRP-1 CD4+ T cells의 450초 움직임 트랙을 예시하는 이미지.
g, eGFP+ TRP-1 CD4+ T cells와 CD11c+ immune cells 간의 antigen-dependent interactions을 평가하기 위한 실험 프로토콜.
h, Arrest coefficient, mean speed 및 eGFP+ TRP-1 CD4+ T cells와 CD11c-Venus cells 간의 relative contact duration.
i, CRISPR-ctrl 및 Trp1-KO melanomas에서 CD11c-Venus cells와 상호 작용하는 eGFP+ TRP-1 CD4+ T cells의 Representative motion tracks.
k, Arrest coefficient, mean speed 및 eGFP+ TRP-1 CD4+ T cells와 CD11c-Venus cells 간의 상대적 relative contact duration.
l, MHC-II blockade이 있거나 없는 CRISPR-ctrl Tyr-KO tumours에서 CD11c-Venus cells와 상호 작용하는 eGFP+ TRP-1 CD4+ T cells의 Representative motion tracks.
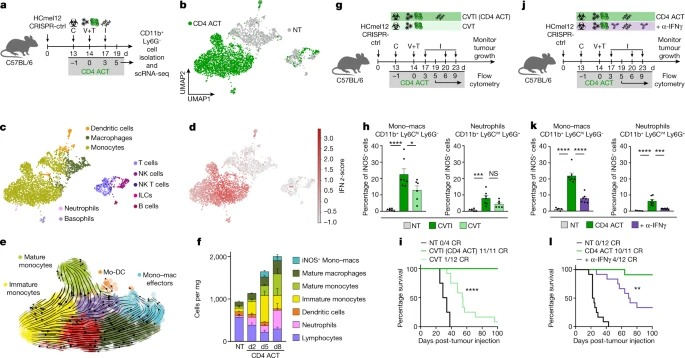
Fig. 3: CD4+ effector T cells와 innate immune stimulation은 monocytes의 모집과 IFN-dependent activation를 촉진하여 이미 발생한 tumours를 박멸합니다.
a, tumour-infiltrating CD11b+ Ly6G- cells의 scRNA-seq analyses을 위한 Experimental protocol.
b, UMAP을 사용한 CD4 ACT-treated and non-treated (NT) 마우스의 single-cell transcriptomes의 Visualization and dimensionality reduction.
c,d, SingleR을 사용하여 할당된 cell types이 있는 UMAP plots (c) 및 각 cells의 hallmark IFN gamma response gene set (MSigDB) 에 대한 z-score(d).
e, CD4 ACT-treated tumours의 monocytes 및 macrophages (Mono-mac)에 대해 UMAP plots에 투영된 RNA velocity.
f, 표시된 대로 처리된 HCmel12 tumours의 Immune cell composition.
g,j, innate stimuli (g) 또는 IFNγ-blockade (j)이 myeloid cell activation and tumour control에 미치는 영향을 조사하기 위한 Experimental treatment protocol.
h,k, intratumoural iNOS+ mono–macs 및 neutrophils의 백분율.
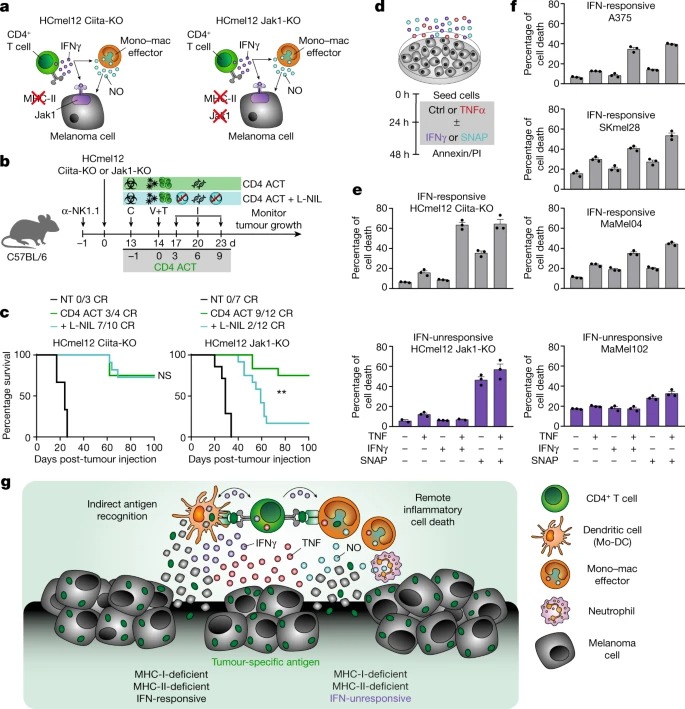
Fig. 4: CD4+ effector T cells은 활성화된 iNOS-expressing tumouricidal monocytes 및 macrophages와 협력하여 MHC-deficient and IFN-unresponsive tumours의 inflammatory cell death을 조율합니다.
a, 표시된 HCmel12 변종의 interaction phenotypes의 Graphical representation.
b, L-NIL을 사용한 chemical iNOS inhibition이 CD4 ACT-mediated tumour control에 미치는 영향을 연구하기 위한 Experimental treatment protocol.
c, HCmel12 Ciita-KO melanomas (왼쪽) 또는 HCmel12 Jak1-KO melanomas (오른쪽)이 확립되고 표시된 대로 치료받은 마우스의 Kaplan–Meier survival graphs.
d, inflammatory mediators TNF, IFNγ 및 nitric oxide donor SNAP가 melanoma cell death를 유도하는 능력을 평가하는 실험 프로토콜.
e,f, 표시된 대로 처리한 마우스(e) 및 인간(f) 흑색종 cells의 cell death 비율.
g, iNOS-expressing myeloid cells와 협력하여 CD4+ T cells에 의한 MHC-deficient and IFN-unresponsive tumours의 inflammatory cell death induction에 대한 Graphical summary.
Disscussion
CD4+ T cells는 주로 direct cytolysis를 통해 tumour cells을 죽이는 CD8+ effector T cells36의 activation을 돕는 helper cells로 인식되어 왔습니다. 우리의 연구에서 우리는 CD4+ effector T cells이 CD8+ cells cytolytic T cells만큼 효율적으로 확립된 tumour를 독립적으로 박멸할 수 있음을 보여주었습니다. 우리는 intravital microscopy를 사용하여 CD4+ 및 CD8+ effector T cells가 tumour 조직에서 작용하는 방식과 부위가 근본적으로 다르다는 것을 발견했습니다. tumour-infiltrating immune cells의 1%에 해당하는 극소수의 CD4+ effector T cells만이 tumour invasive margins에 위치하여 CD11c+MHC-II+ antigen-presenting immune cells cells과 상호작용하고 tumour를 간접적으로 제거합니다. 이와 대조적으로, 훨씬 더 많은 수의 CD8+ cells cytolytic T cells는 tumour 중심부로 침투하여 MHC-I-expressing tumour cells를 직접 표적으로 삼아 죽입니다.
추가적인 innate immune stimulation은 CD4+ T cells의 TH1-directed differentiation을 촉진하고, mmature monocytes의 tumour microenvironment로의 모집을 증가시키며, antigen-presenting and iNOS-expressing tumouricidal effector phenotypes에 대한 IFN-dependent activation and differentiation을 지원했습니다. CD4+ T cells와 IFN-activated mononuclear phagocytes는 함께 ‘outside-in’ 작용하는 indirect inflammatory tumour cell death process를 시작하며, IFNγ를 중화하여 이 과정을 무력화할 수 있습니다. 이 독특한 작용 방식은 NK cells의 direct cytolytic activities 과 병행하여 독립적으로 작동하며 CD8+ cells 용해 T cells의 direct recognition and destruction을 회피하는 MHC-deficient and IFN-unresponsive tumours를 박멸할 수 있습니다(확장 데이터 그림 10).
immune defence를 위해 mononuclear phagocytes와 협력하는 lymphocytes의 능력은 50여 년 전 병원균과 tumour에 대한 생쥐의 immune resistance를 이해하려는 연구자들의 세균 감염 실험에서 처음 관찰되었습니다. 우리는 실험 모델에서 이러한 협력의 근간이 되는 cells 및 molecular mechanisms을 충실히 요약합니다. myeloid cells에 의한 MHC-II-dependent antigen presentation, monocyte–macrophage and dendritic cell lineages의 dynamic IFN-dependent activation and differentiation, inflammatory mediators를 통한 remote cell death induction은 tumour 및 pathogens 제어에 결정적으로 기여하는 shared immune defence mechanisms을 대표할 수 있습니다.
CD4+ T cells를 이용한 ACT immunotherapies가 이미 임상 연구에서 성공적으로 시행되었기 때문에 이번 연구 결과는 환자 치료의 미래에 중요한 의미를 갖습니다. metastatic melanoma를 성공적으로 치료하기 위해 NY-ESO-1 specific CD4+ T cells를 이용한 ACT를 사용했으며, cancer germline antigen MAGE-A3를 특이적으로 인식하는 MHC-II–restricted T cell receptor를 발현하도록 유전자 조작된 CD4+ T cells를 이용한 ACT는 임상적 효능을 입증했습니다. 이러한 결과는 myeloid cells이 immune-evasive tumours에 대한 CD4+ T cells effector 기능의 잠재력을 최대한 발휘할 수 있도록 적절한 활성화 자극을 포함하는 ACT-based therapeutic strategies의 임상 개발을 강력하게 뒷받침합니다.