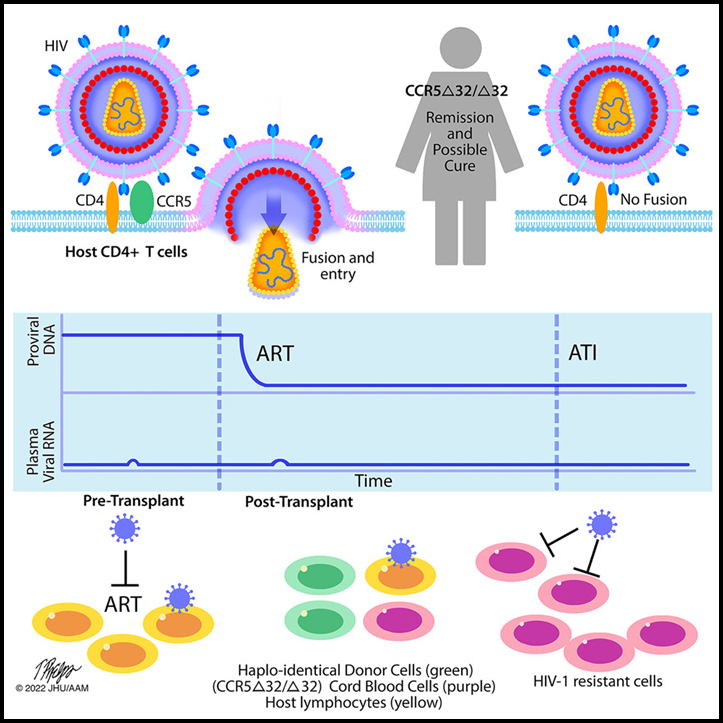
Haplo-cord 혈액 이식 후 여성의 HIV-1 완화 및 가능한 치료
Abstract
앞서 남성 2명이 CCR5Δ32 동형접합체 (CCR5Δ32/Δ32) 동종성체줄기세포이식을 통해 HIV-1을 완치한 바 있습니다. 우리는 급성 골수성 백혈병 (AML)을 치료하기 위해 CCR5Δ32/Δ32 일배체 이식 (성인의 일배체 줄기 세포와 결합된 제대혈 세포)을 받은 혼혈 여성에서 첫 번째 완화 및 가능한 HIV-1 치료를 보고합니다.
말초 혈액 키메라증은 이식 후 14주까지 100% CCR5Δ32/Δ32 제대혈이었고 4.8년의 추적 기간 동안 지속되었습니다. 면역 재구성은 (1) 검출 가능한 복제 가능한 HIV-1 저장소의 손실, (2) HIV-1 특이적 면역 반응의 손실, (3) 이식 전 자가 조직을 포함한 X4 및 R5 실험실 변이체에 대한 시험관내 내성과 관련이 있었습니다. 잠복 저장고 분리체, (4) 이식 후 37개월부터 시작하여 항레트로바이러스 요법 없이 18개월 동안 항레트로바이러스 치료를 받지 않는 무바이러스 혈증을 동반한 HIV-1 통제를 했습니다.
CCR5Δ32/Δ32 일배체 이식은 급성 백혈병에 대한 줄기 세포 이식이 필요한 HIV-1을 가지고 살고 있는 다양한 조상의 사람에 대해 관해 및 가능한 HIV-1 치료를 달성했습니다.
Figure
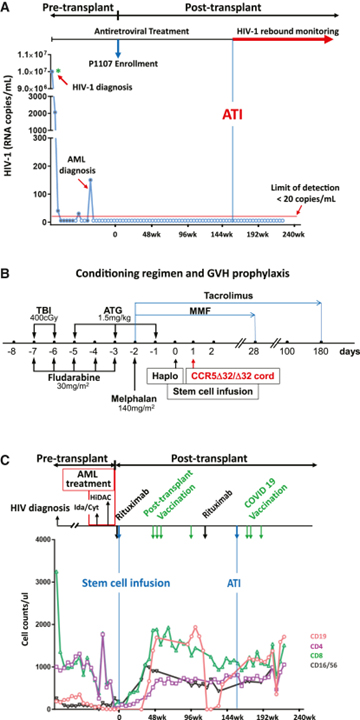
[Figure 1] HIV-1 및 AML 치료 과정 및 반동 모니터링
(A) HIV-1 진단 시, AML 진단 전후 및 줄기 세포 이식 시 HIV-1 혈장 바이러스 로드. 참가자는 ART에서 HIV-1 제어로 줄기 세포 이식 당시 P1107 시험에 등록되었습니다. 파란색 선은 이식에 비해 항레트로바이러스 치료 중단(ATI)의 타이밍을 나타냅니다. 18개월 동안 ART에서 바이레믹 반동이 없었습니다. 임상 분석에서는 빨간색 선으로 표시된 <20 copies/mL의 검출 한계로 혈장 바이러스 부하(VL)를 측정했습니다. 진단 시 HIV-1 VL은 녹색 별표로 표시된 정량 상한(1,000,000 copies/mL)보다 컸습니다.
(B) haplo-cord 줄기 세포 이식의 스키마. 참가자는 기관 표준 치료에 따라 동종 줄기 세포 이식을 받았습니다. 컨디셔닝 요법은 -7~-3일에 매일 플루다라빈 30mg/m2, -2일에 멜팔란 140mg/m2 x 1 용량, -7~-6일에 400CGy에서 전신 방사선 조사였습니다. 일배체 줄기 세포를 0일에 주입하고 CCR5 Δ32/Δ32 제대 줄기 세포를 +1일에 주입했습니다. 이식편대숙주(GVH) 질병 예방에는 다음이 포함됩니다: -5일, -3일 및 -1일에 항흉선세포 글로불린(ATG) 1.5mg/kg; 마이코페놀레이트 모페틸(MMF) 1g -2일부터 +28일까지 매일 세 번; 및 이식 후 -2일부터 180일까지의 타크로리무스.
(C) 임상 과정, 이식 전 면역 상태 및 이식 후 면역 재구성. T 세포(CD4, CD8), B 세포(CD19) 및 자연 살해(NK) 세포(CD16/CD56) 수준. 유도 화학요법은 이다루비신/시타라빈(ida/cyt)과 고용량 시타라빈 화학요법의 1주기 통합으로 구성되었습니다. 첫 번째 파란색 선은 조건화 화학 요법 후 줄기 세포 주입 시간을 보여줍니다. Rituximab(375 mg/m2)은 Epstein-Barr 바이러스(EBV) 관련 이식 후 림프증식성 질환의 예방을 위한 컨디셔닝 요법 1주 전에 제공되었습니다. EBV 바이러스혈증 치료를 위해 두 번째 용량의 리툭시맙을 투여했습니다. Rituximab은 완전한 회복 전에 일시적인 감지할 수 없는 CD19 수준을 초래했습니다. ATI(두 번째 파란색 선), 이식 후 예방 접종(녹색 화살표) 및 mRNA 백신을 사용한 COVID-19 백신 접종(녹색 화살표).
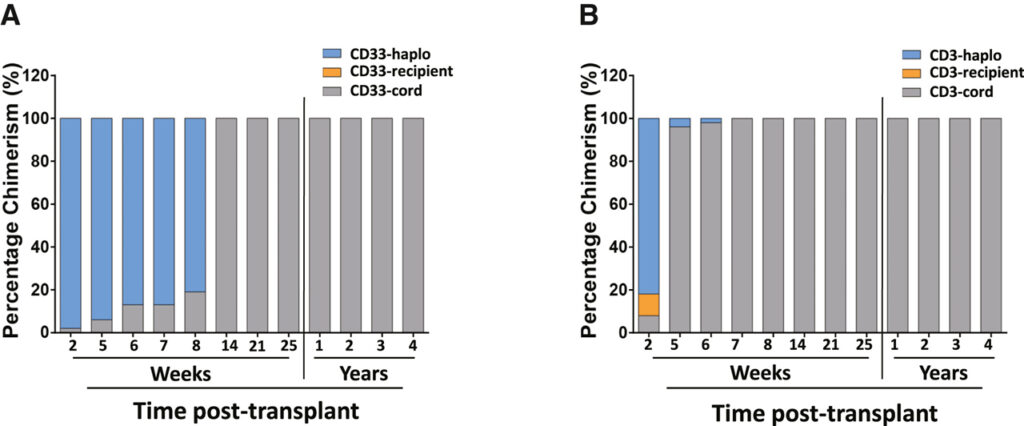
[Figure 2] 시간 경과에 따른 하플로코드 줄기 세포 이식 후 키메라 역학
(A) 골수 혈통 키메라증은 CD33에 의해 측정되었습니다.
(B) 림프계통 키메라증은 CD3에 의해 측정되었다. 이식 후 14주까지 CD3 및 CD33 키메라 현상은 100% CCR5 Δ32/Δ32 CBU 세포에 있었고 이식 후 4년 동안 유지되었습니다. 수혜자(주황색 음영), 일배체 기증자(파란색) 및 제대혈 세포(회색) 키메라 현상. 검은색 선은 몇 주에서 몇 년으로의 시간 변화를 나타냅니다.
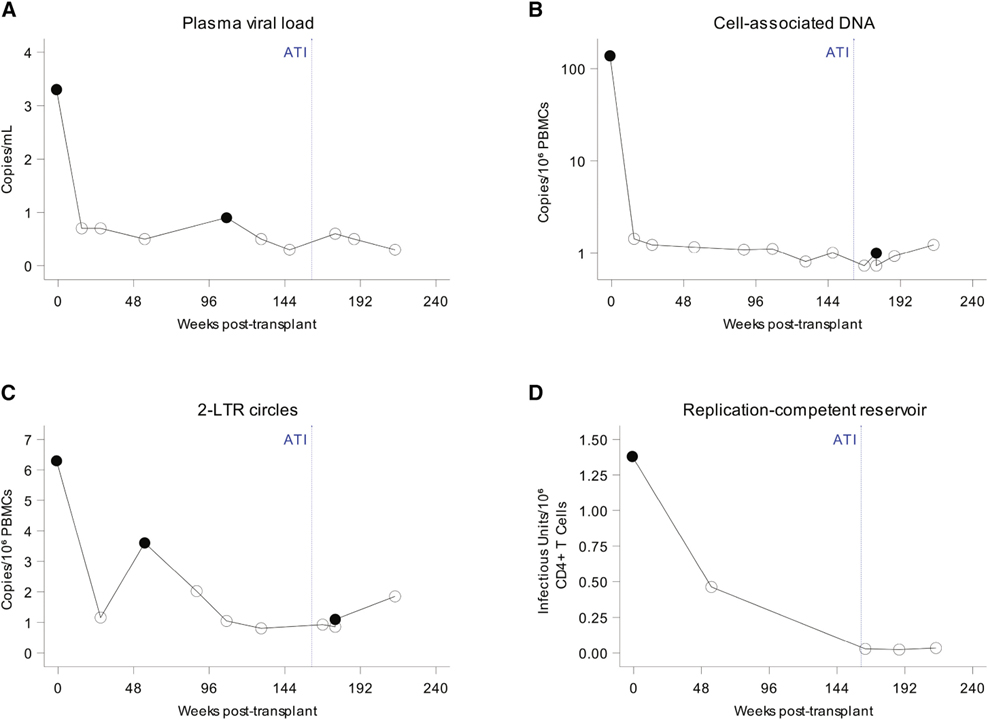
[Figure 3] 이식 전 및 이식 후 HIV-1 지속성의 바이오마커
(A) 단일 카피 바이러스 부하 분석으로 정량화된 혈장 바이러스 부하(HIV-1 RNA 복사본/mL); 혈장 바이러스 부하 분석의 검출 한계는 <0.5에서 <0.9 HIV-1 RNA copies/mL 범위였습니다.
(B) <의 검출 한계(시간의 95% 검출된 농도)로 분석된 1.25 카피/1 × 106 세포를 검출하는 액적 디지털 PCR 분석으로 측정된 세포 관련 HIV-1 DNA(카피/106 세포) 4.09카피/106셀.
(C) 액적 디지털 PCR 분석으로 분석된 2-LTR 원(사본/106개 세포).
(D) QVOA에 의해 결정된 잠재 저장소 크기는 IUPM(infectious units per million) CD4+ T 세포로 표현됩니다.
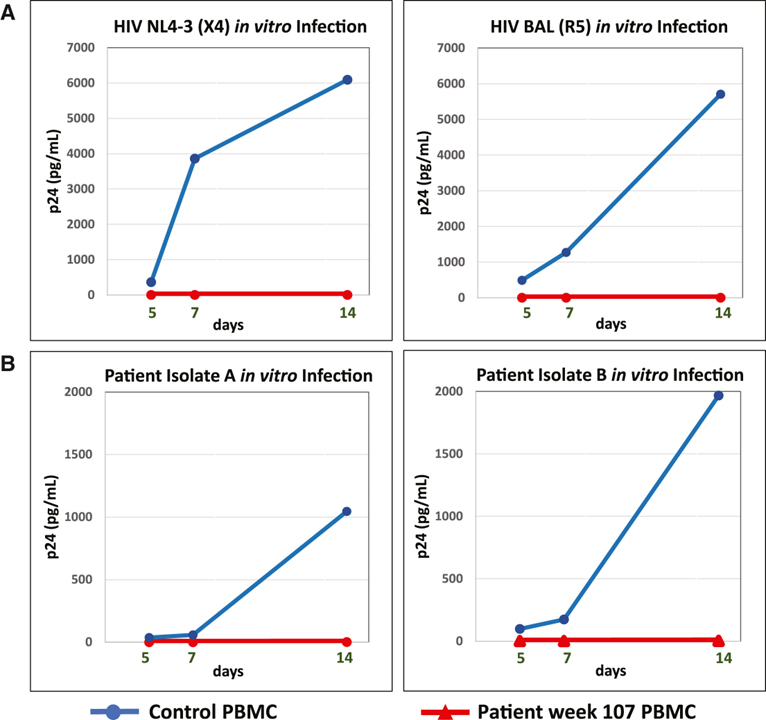
[Figure 4] 시험관내 HIV-1 저항성
(A) 이식 후 107주차 환자 PBMC(빨간색 선)의 CCR5-트로픽(HIV-1-BAL) 및 CXCR4-트로픽(HIV-1-NL4-3)에 대한 시험관내 내성을 건강한 대조군 PBMC에서의 복제와 비교( 파란색 선), 배양 상청액에서 p24 항원으로 측정.
(B) p24 항원에 의해 측정된 건강한 대조군 PBMC(파란색 선)의 복제와 비교하여 이식 전 분리된 2개의 자가 잠복 저장소 클론(A 및 B)에 대한 이식 후 107주(빨간색 선) 환자 PBMC의 시험관내 저항성 배양.
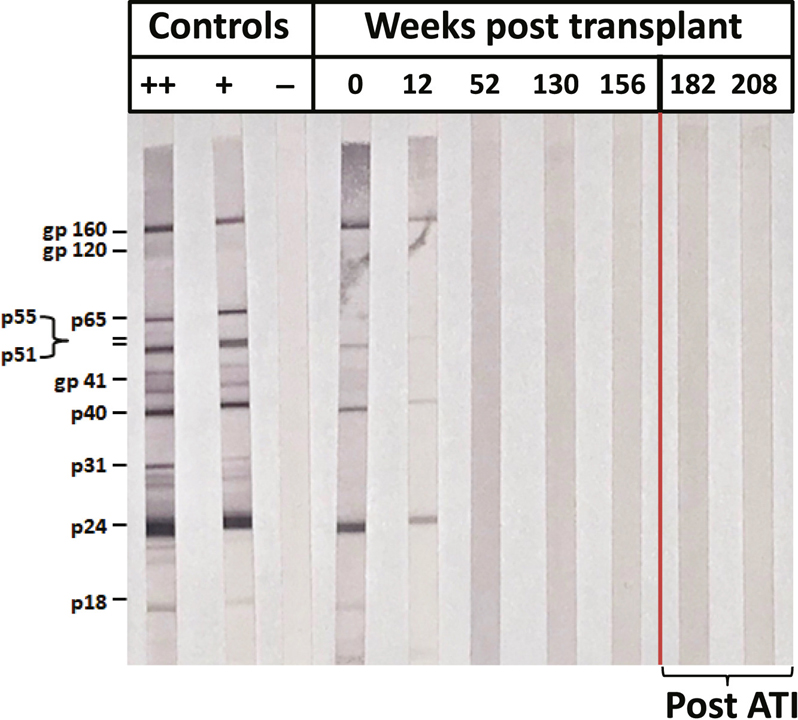
[Figure 5] 웨스턴 블롯에 의한 HIV-1 항체 프로필
HIV-1 단백질 및 분자량이 표시됩니다. 검출 가능한 HIV-1 항체는 IMPAACT P1107(제0주) 진입 시 고(++) 및 저(+) 양성 및 음성(음성) 대조군 및 항체 프로파일과 후배포 코드 이식 후 여러 시점에 나타납니다. -ATI. 이식 후 52주까지 HIV-1 항체 반응의 손실이 있었고 ATI 후에도 유지되었습니다(빨간색 선).
Disscussion
우리는 AML 및 HIV-1을 치료하기 위해 일배체 이식 이식과 결합된 CCR5Δ32/Δ32 CBU 후 혼혈 여성에서 관해 및 가능한 HIV-1 치료의 첫 사례를 보고합니다. 성체 CCR5Δ32/Δ32 기증자 줄기 세포는 Timothy Brown과 Adam Castillejo에서 사용되었고 뒤셀도르프 환자에서 차도 가능성이 있었습니다. 이 사례는 또한 HIV-1 치료 매개에서 HIV-1에 대한 CCR5Δ32/Δ32 세포의 본질적인 저항성이 중요한 역할을 한다는 점증하는 증거를 추가합니다. 검출할 수 없는 HIV-1 DNA 및 복제 유능 저장소를 달성했음에도 불구하고 ART 중단 32주 이내에 바이레믹 리바운드를 경험했습니다.
우리의 사례 연구는 또한 인종적 건강 형평성에 영향을 미칩니다. 베를린 및 뒤셀도르프 환자에서 CCR5Δ32/Δ32 세포에 대한 고려 없이 HLA가 동일한 성인 비혈연 기증자 일치를 찾을 가능성은 약 72%였습니다. 히스패닉과 네덜란드 혈통의 런던 환자에 대한 기회는 41%-44%였습니다. 혼혈인 환자의 경우 확률이 20% 미만이었습니다. 일치 요구 사항이 덜 엄격하기 때문에 CCR5Δ32/Δ32 CBU CB 세포를 사용하면 다양한 혈통을 갖고 있고 다른 질병에 대한 이식이 필요한 PLWH에서 CCR5Δ32/Δ32 요법의 기회를 넓힐 수 있습니다.