RADAR 초분자 항-파지 방어 복합체의 Cryo-EM 구조
Abstract
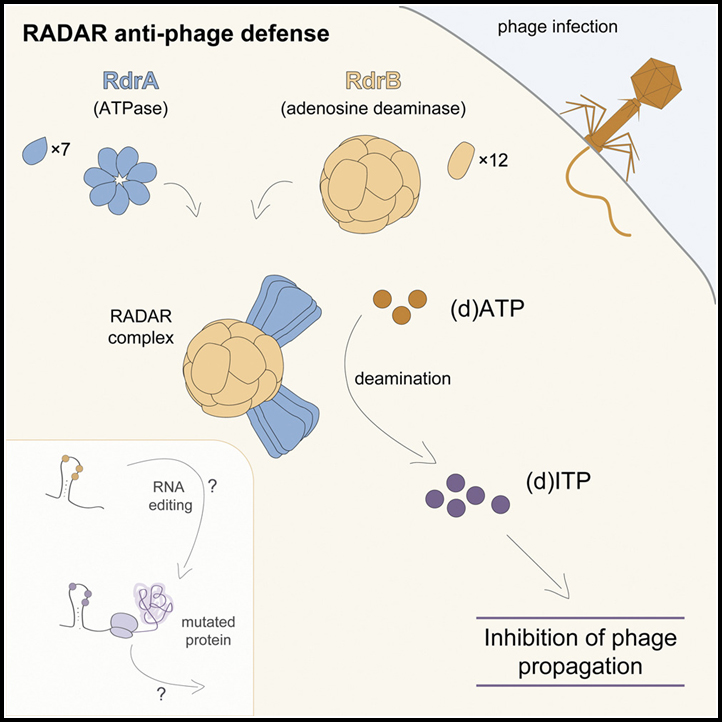
RADAR는 메신저 RNA를 “편집”하여 파지를 방어하는 것으로 보고된 2개의 단백질 박테리아 방어 시스템입니다. 이 연구에서는 RADAR 방어 복합체의 cryo-EM 구조를 결정하여 RdrA를 heptameric, 2개의 층으로 구성된 AAA+ ATPase로, RdrB를 12개의 표면에 노출된 deaminase 활성 사이트가 있는 dodecameric, hollow complex로 나타냅니다. RdrA와 RdrB는 결합되어 최대 10MDa의 거대한 어셈블리를 형성하며 RdrA는 RdrB 활성 사이트 위에 깔때기 형태로 도킹됩니다.
놀랍게도, 우리의 구조는 모노뉴클레오티드를 표적으로 하는 RdrB 활성 부위를 드러냅니다. 이 결과는 RdrB가 체외에서 ATP-to-ITP 전환을 촉매하고 파지 복제를 제한하는 생체 내 파지 감염 동안 이노신 모노뉴클레오티드의 대량 축적을 유도한다는 것을 보여줍니다. 우리의 연구는 ATP 모노뉴클레오티드 탈아미노화를 RADAR 면역의 결정 요인으로 정의하고 항-파지 방어 메커니즘으로서 뉴클레오티드 변형 기계의 초분자 어셈블리를 밝힙니다.
Figure
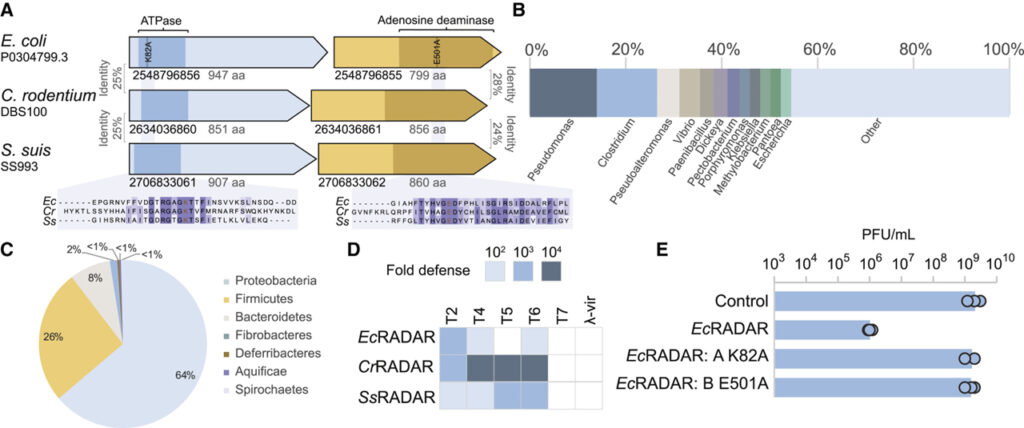
[Figure 1] 다양한 RADAR 시스템이 파지 복제로부터 대장균을 보호합니다.
(A) RADAR 시스템.
(B) RADAR를 암호화하는 박테리아의 속.
(C) RADAR 인코딩 박테리아의 문 분포.
(D) RADAR 시스템의 파지 방어.
(E) EcRADAR의 방어 활동에 대한 점 돌연변이의 영향.
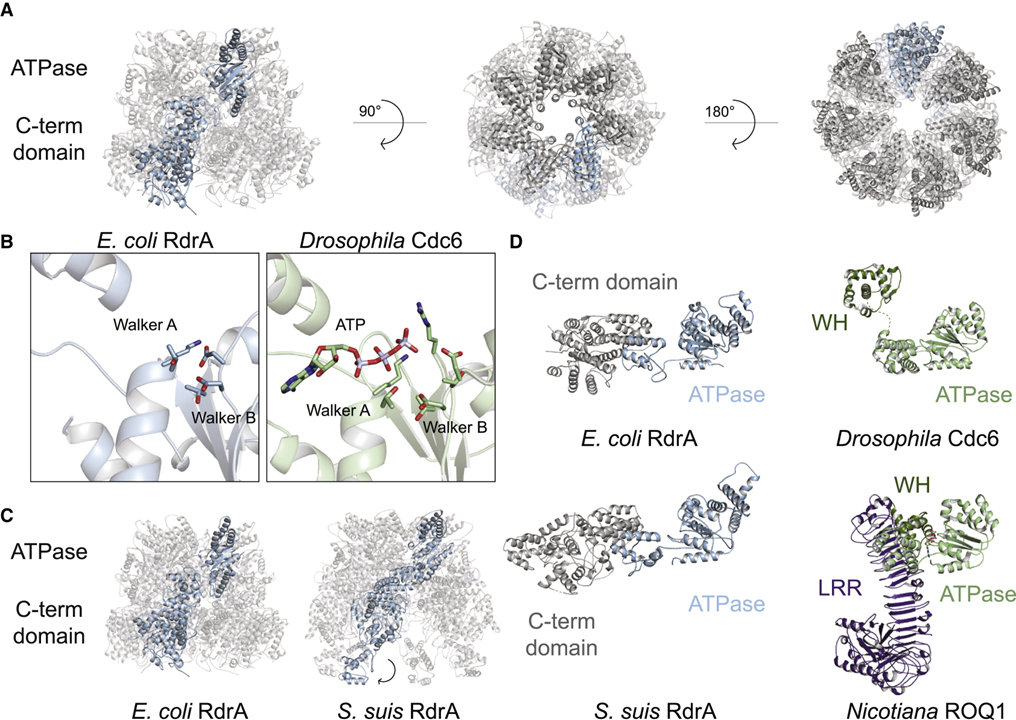
[Figure 2] RdrA의 구조는 고유한 C-말단 도메인을 가진 2층 구조의 heptamer ATPase 어셈블리를 나타냅니다.
(A) E. coli RdrA cryo-EM 구조.
(B) E. coli RdrA와 Drosophila Cdc6 활성 부위의 비교.
(C) E. coli RdrA와 S. suis RdrA의 비교.
(D) E. coli 및 S. suis RdrA와 ATPase 도메인 함유 단백질의 비교.
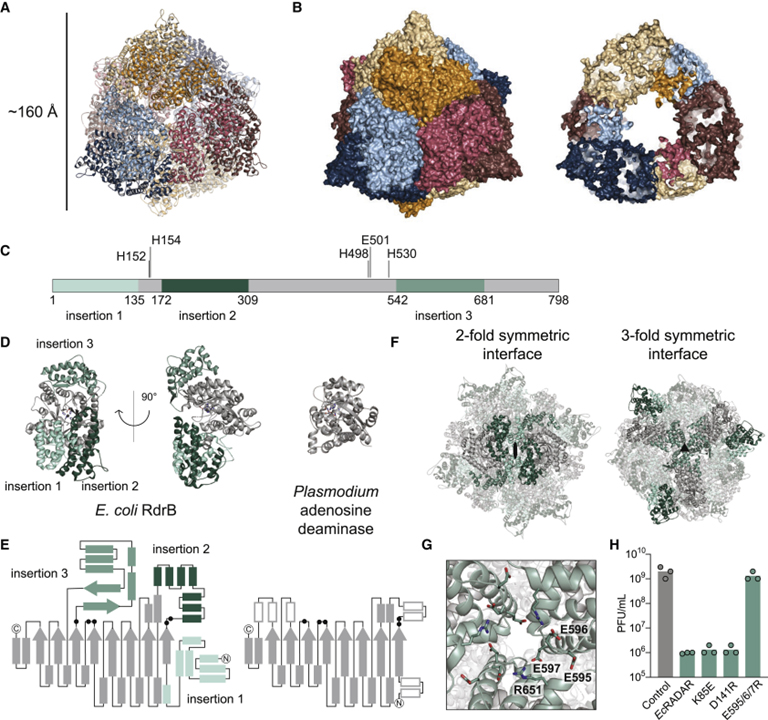
[Figure 3] RdrB의 구조는 아데노신 deaminase dodecamer를 나타냅니다.
(A) E. coli RdrB dodecamer의 구조.
(B) E. coli RdrB dodecamer (왼쪽)의 표면 표현 및 속이 빈 중심 (오른쪽)을 보여주는 슬라이스.
(C) 다른 아데노신 deaminase에 비해 RdrB에 삽입을 보여주는 개략도.
(D, E) Plasmodium adenosine deaminase (오른쪽)와 비교하여 녹색 (왼쪽) 음영으로 삽입을 강조하는 단일 RdrB 단량체의 구조 (D) 및 개략도 (E).
(F) 각 삽입 형태에 따른 symmetric dodecamer 인터페이스.
(G) (F)에 표시된 3-fold 인터페이스의 클로즈업.
(H) EcRADAR의 방어 활동에 대한 RdrB 다중화 인터페이스를 방해하는 것으로 제안된 점 돌연변이의 효과.
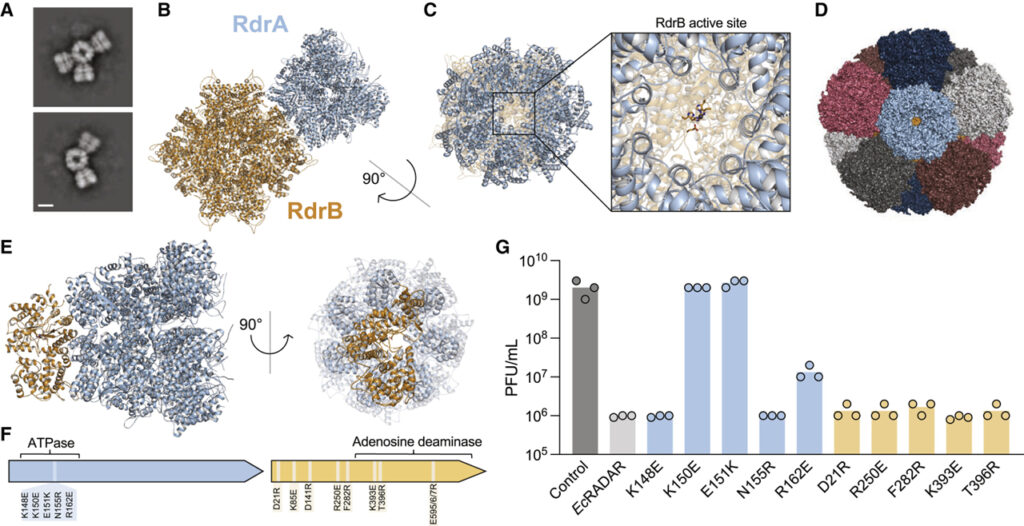
[Figure 4] RdrA와 RdrB는 항-파지 방어에 필요한 초분자 복합체를 형성합니다.
(A) RdrA-RdrB 혼합물의 cryo-EM 2D 클래스 평균.
(B) RdrB dodecamer (노란색)와 복잡한 RdrA heptamer (파란색)의 구조.
(C) RdrB 활성 사이트에 대한 액세스를 보여주는 RdrA heptamer의 구조.
(D) 12개의 프로토머 각각에 결합된 RdrA heptamer가 있는 RdrB dodecamer 모델.
(E) RdrB 모노머 및 RdrA heptamer 모델.
(F) RdrA 및 RdrB의 돌연변이 위치.
(G) EcRADAR의 방어 활동에 대한 RdrA-RdrB 복합체를 파괴하는 것으로 제안된 점 돌연변이의 효과.
[Figure 5] RdrB의 구조 분석은 뉴클레오티드 기질의 표적화를 시사합니다.
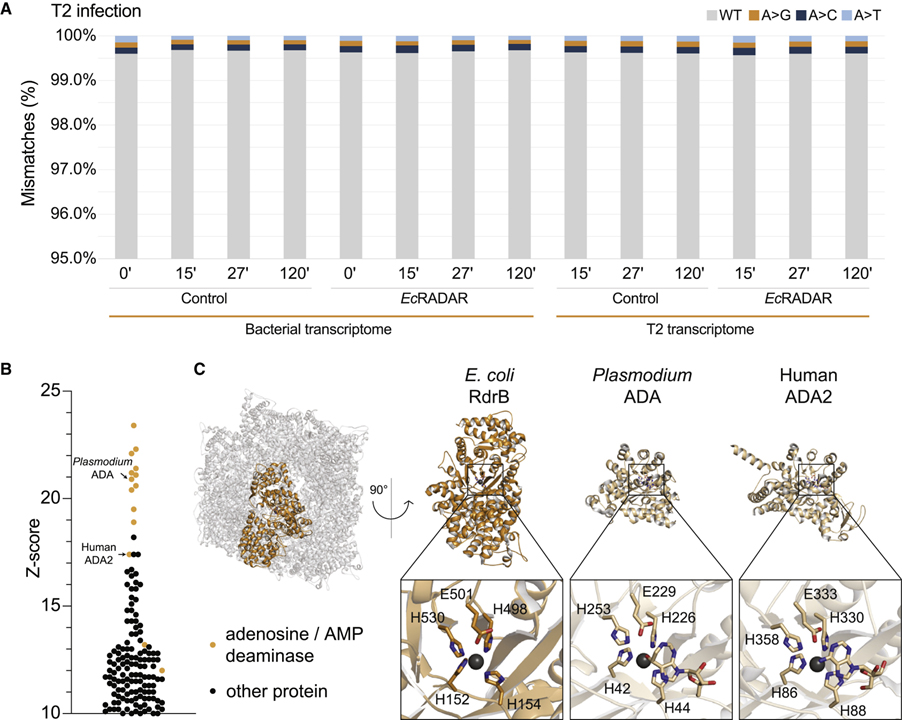
(A) 아데닌 위치에서 시퀀싱된 RNA와 게놈 DNA 사이의 불일치.
(B) RdrB와 유사한 단백질 구조의 DALI Z 점수.
(C) RdrB dodecamer의 구조 비교.
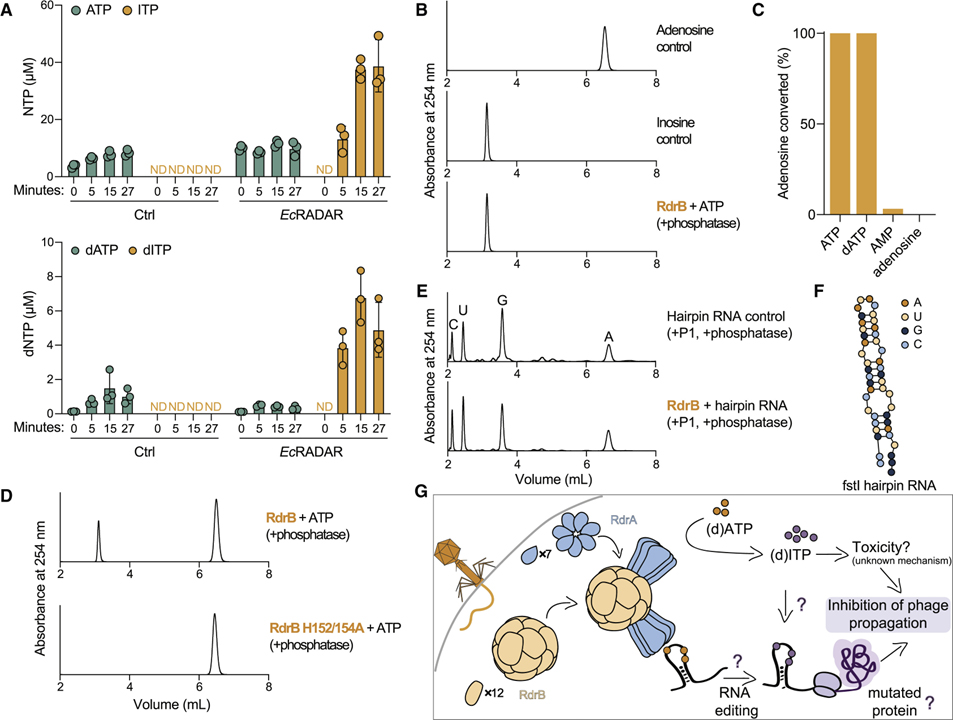
[Figure 6] RADAR는 항-파지 방어에서 ATP-to-ITP 전환을 중재합니다.
(A) EcRADAR 또는 제어 플라스미드를 포함하는 세포에서 추출한 용해물에서 ATP, dATP, ITP, dITP의 정량적 질량 분석.
(B) 정제된 E. coli RdrB와 배양 후 ATP의 HPLC 분석.
(C) 30분 동안 1μM RdrB와 함께 인큐베이션된 1mM 서로 다른 뉴클레오티드 기질의 HPLC 분석.
(D) RdrB의 활성 부위 내 보존된 히스티딘 잔기의 돌연변이..
(E) 각 염기의 정체를 평가하기 위한 헤어핀 RNA 분해 후 뉴클레오티드의 HPLC 분석.
(F) (E)에서 사용된 fstI 헤어핀 RNA의 개략도.
(G) RADAR 방어 시스템의 작동 메커니즘에 대한 개략도.
Disscussion
우리의 결과는 RADAR 방어 시스템이 아데노신 뉴클레오티드를 표적으로 하고 파지 복제로부터 박테리아를 보호하는 초분자 복합체를 형성한다는 것을 보여줍니다. Cryo-EM 구조는 RADAR 복합체 조립 메커니즘을 정의하고 heptamer RdrA 서브유닛이 핵심 dodecamer RdrB 쉘 주위에 도킹하여 거대한 꽃 모양의 방어 복합체를 생성함을 보여줍니다. RdrA 소단위체는 RdrB 활성 부위 위에 깔때기를 형성하고 우리는 RdrB 촉매 중심이 AMP와 같은 모노뉴클레오티드 기질에 작용하는 아데노신 deaminase와 구조적으로 상동임을 보여줍니다. 파지 감염 시 RADAR는 ITP와 dITP의 빠른 축적을 유도합니다. 정제된 RdrB는 시험관 내에서 ATP를 ITP로, dATP를 dITP로 전환하는 것을 촉매하여 RADAR가 모노뉴클레오티드 기질을 표적화하는 직접적인 능력을 확인했습니다. 아데노신 모노뉴클레오티드의 효율적인 표적화와 달리, 우리는 파지 방어 동안 RNA에 대한 A-to-G 돌연변이 서명의 미미한 존재만을 기록했으며 ATP가 ITP로 강력하게 변환되는 조건에서 시험관 내에서 RNA 편집을 감지할 수 없었습니다. 우리는 이노신 유도체의 급속한 축적이 뉴클레오티드 풀을 독살하여 파지 복제를 억제하고 유산 감염을 유도하는 모델을 제안합니다. 이노신 유도체의 축적이 세포에 유독하다는 가설과 일치하여, 파지 감염이 없는 상태에서 RdrB의 과발현은 ITP 축적 및 세포 독성을 초래합니다. (d)ITP의 대량 축적이 DNA 또는 RNA에 잘못 통합될 수 있지만 파지 감염 후 세포에서 ITP 축적의 정확한 영향은 알려져 있지 않습니다. 초기 DNA 또는 RNA에 (d)ITP의 통합은 시퀀싱 접근 방식으로 감지할 수 없습니다. 시토신과의 염기쌍에 대한 구아노신 대신 이노신의 잘못된 통합은 구아노신의 서열 시그니처를 보여줄 가능성이 높기 때문에 이러한 잘못된 통합은 문제가 생깁니다. RADAR 활성화 및 (d)ITP 축적 후 감염으로 이어지는 것이 정확히 무엇인지 이해하려면 향후 연구가 필요합니다.
세포 뉴클레오티드 풀은 바이러스 복제를 방해하는 숙주 지향적 면역 반응의 공통 표적으로 부상했습니다. 동물 세포에서 SAMHD1은 레트로바이러스 및 헤르페스바이러스를 포함한 바이러스의 복제를 제한하기 위해 dNTP를 고갈시키는 트리포스포하이드롤라아제 효소입니다. 세포에서 사용 가능한 뉴클레오타이드, 동물 세포 및 박테리아의 면역 시스템은 바이페린 효소를 사용하여 다양한 바이러스 및 파지의 복제를 방해하는 사슬 종결자 역할을 하는 CTP 유도체를 포함한 뉴클레오타이드 유사체를 합성합니다. 이노신 뉴클레오타이드의 RADAR 합성은 기계적으로 유사한 뉴클레오티드 오입을 증가시키고 기능을 위해 ATP 가수분해를 필요로 하는 풍부한 바이러스 효소를 잠재적으로 억제하여 방어를 형성하고 파지 복제를 제한합니다. 게놈 합성에 필요한 막대한 대사 요구는 숙주가 자유 뉴클레오티드를 표적으로 삼고 바이러스 복제를 방해하기 위한 기회를 만듭니다. 우리의 연구 결과는 이노신 뉴클레오타이드의 RADAR 합성의 장점은 감염이 없을 때 낮은 수준의 ATP-to-ITP 전환과 관련된 상대적으로 낮은 독성과 파지 복제 및 완전한 시스템 활성화에 있다고 보입니다.
우리의 구조 분석에서 가장 놀라운 발견 중 하나는 RADAR 구성 요소가 거대하고 매우 특이한 멀티메릭 어셈블리를 형성한다는 것입니다. 일부 CRISPR 면역 시스템은 침입하는 바이러스 핵산을 감지하고 방어를 탑재하기 위해 큰 복합체를 형성하지만 RADAR 방어에서 반복 서브유닛의 광범위한 다중화의 특정 역할은 알려져 있지 않습니다. 그러나 RdrA 및 RdrB 다중화 또는 RdrA-RdrB 복합체 형성을 방해하는 돌연변이는 생체 내 방어를 억제하고 파지 복제 억제에 완전한 조립이 필요함을 분명히 보여줍니다. Inflammasome, Toll-like 수용체, RIG-I 유사 수용체 및 cGAS-STING 신호 경로를 포함하는 포유류 선천 면역의 공통 주제는 병원균 탐지와 다운스트림 면역 활성화를 향상시키는 중요한 단계로서의 초분자 복합체 어셈블리입니다. 단백질 올리고머화 CBASS 면역에서 이펙터 활성화를 위해 다중화도 필요하며, RADAR 복합체 조립이 특히 항-파지 방어를 가능하게 하는 효소 활성을 향상시킬 수 있음을 시사합니다. RdrA 및 RdrB의 구조와 모노뉴클레오타이드 표적화의 발견을 기반으로 향후 연구는 RADAR 복합체 형성이 효소 기능 및 항-파지 방어를 조절하는 방법을 설명할 것입니다.