SARS-CoV-2 BQ 및 XBB 하위 변이체의 놀라운 항체 회피 특성 상승
Abstract
SARS-CoV-2 Omicron의 BQ 및 XBB 하위 변종은 현재 빠르게 확장되고 있으며, 이는 아마도 추가 스파이크 돌연변이에서 파생된 변형된 항체 회피 특성 때문일 수 있습니다.
이 연구에서는 백신 접종자와 감염된 사람의 혈청에 의한 BQ.1, BQ.1.1, XBB, XBB.1의 중화가 현저하게 손상되었음을 보고합니다. 여기에는 WA1/BA.5 2가 mRNA 백신으로 강화된 개인의 혈청도 포함됩니다. BQ 및 XBB 하위 변이체에 대한 역치는 현재까지 관찰된 것보다 각각 13~81배 및 66~155배 더 낮았습니다. 원래의 Omicron 변이체를 중화할 수 있는 단일클론 항체는 이러한 새로운 하위 변이체에 대해 대체로 비활성이었고 책임 있는 개별 스파이크 돌연변이가 확인되었습니다. 이러한 하위 변이체는 이전 변이체와 유사한 ACE2 결합 친화도를 갖는 것으로 밝혀졌습니다.
이와 함께, 우리의 연구 결과는 BQ 및 XBB 하위 변이체가 현재 COVID-19 백신에 심각한 위협을 가하고, 승인된 모든 항체를 비활성화하며, 항체를 회피하는 이점 때문에 바이러스 인구에서 우세를 얻었을 수 있음을 나타냅니다.
Figure
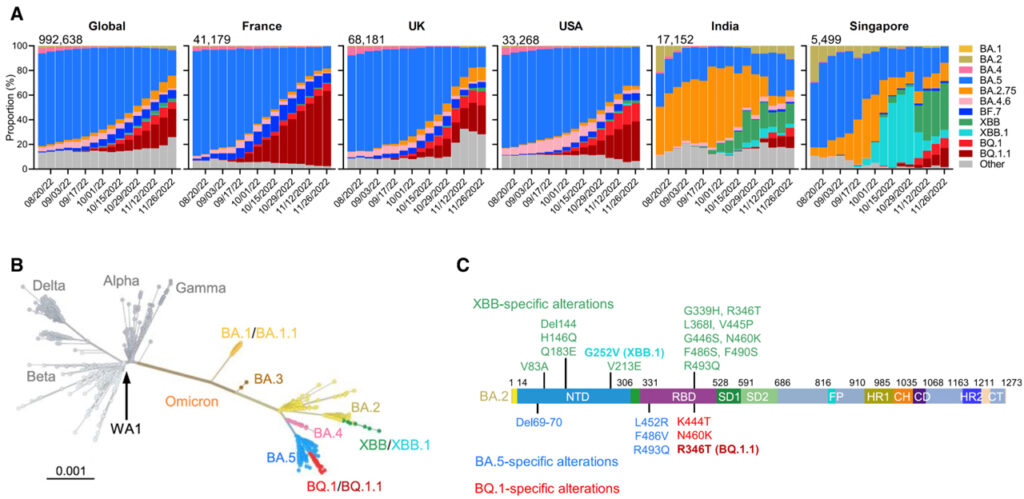
[Figure 1] SARS-CoV-2 Omicron BQ.1, BQ.1.1, XBB 및 XBB.1 하위 변종의 증가
(A) 모든 인플루엔자 데이터 공유에 관한 글로벌 이니셔티브 (GISAID)의 Omicron 하위 변형 빈도.
(B) 다른 주요 SARS-CoV-2 변종과 함께 Omicron 하위 변이체의 뿌리가 없는 계통수.
(C) BA.2의 배경에 있는 XBB 및 XBB.1과 BA.4/5의 배경에 있는 BQ.1 및 BQ.1.1에서 발견되는 주요 스파이크 돌연변이.
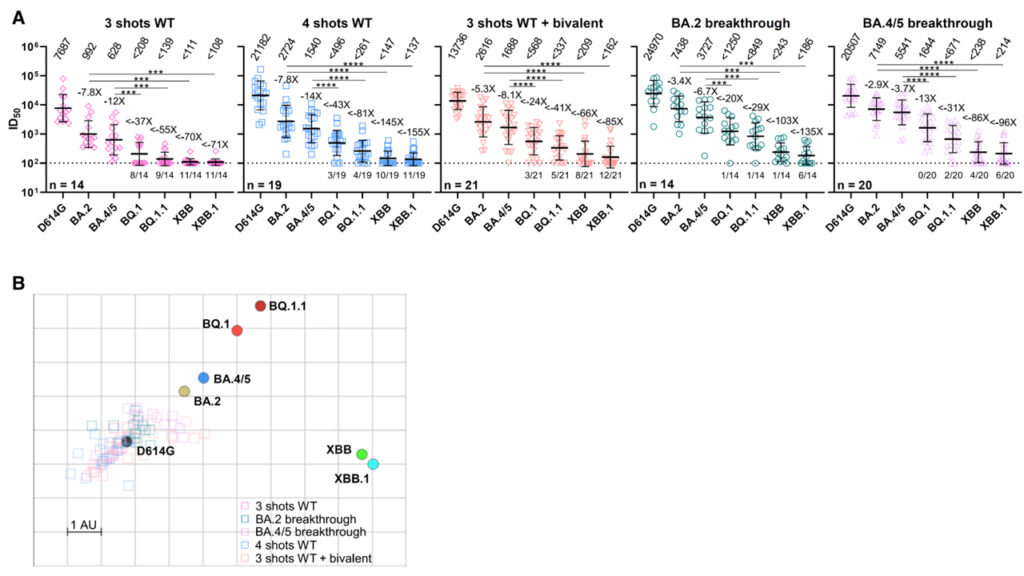
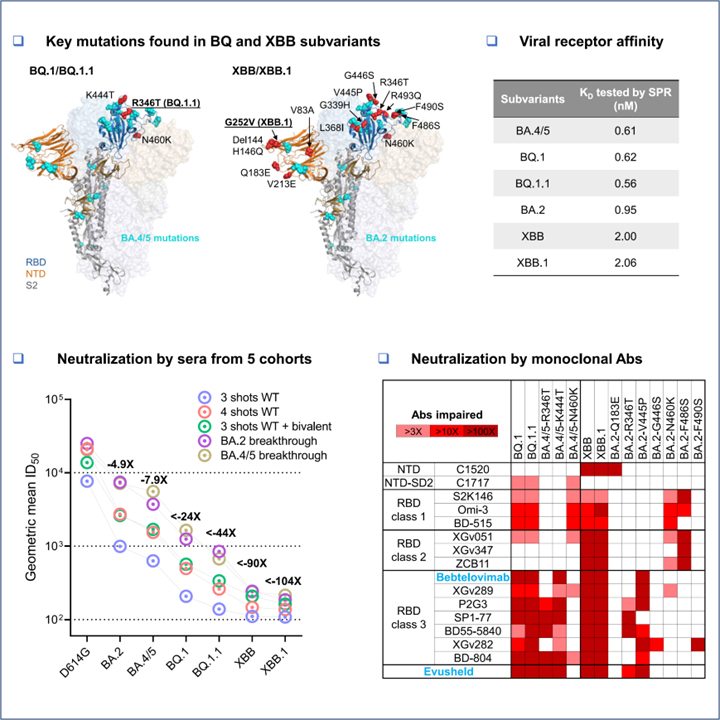
[Figure 2] Omicron subvariants BQ.1, BQ.1.1, XBB 및 XBB.1의 혈청 중화
(A) 표 S1에 요약 된 임상 정보와 함께 5 가지 임상 코호트의 혈청에 의한 pseudotyped D614G 및 Omicron subvariants의 중화.
(B) (A)의 혈청 중화 데이터를 기반으로 한 항원 지도.
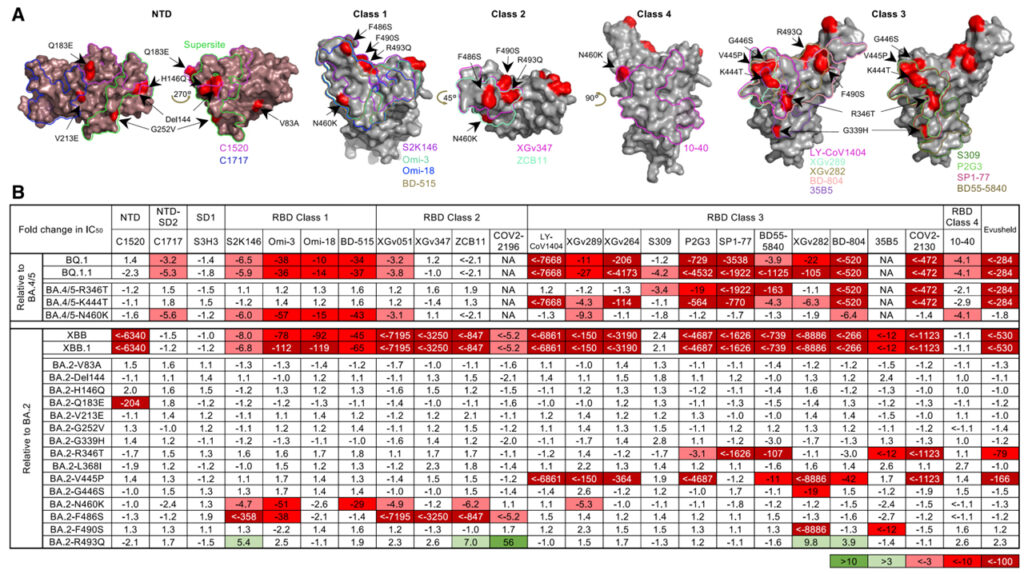
[Figure 3] 단일클론 항체 중화에 대한 Omicron subvariants의 저항성
(A) 테스트된 NTD- 및 RBD-지시 항체의 footprint.
(B) BA.4/5 또는 BA.2와 비교하여 BQ.1, BQ.1.1, XBB, XBB.1 및 개별 돌연변이체 중화 IC50 값의 변화.
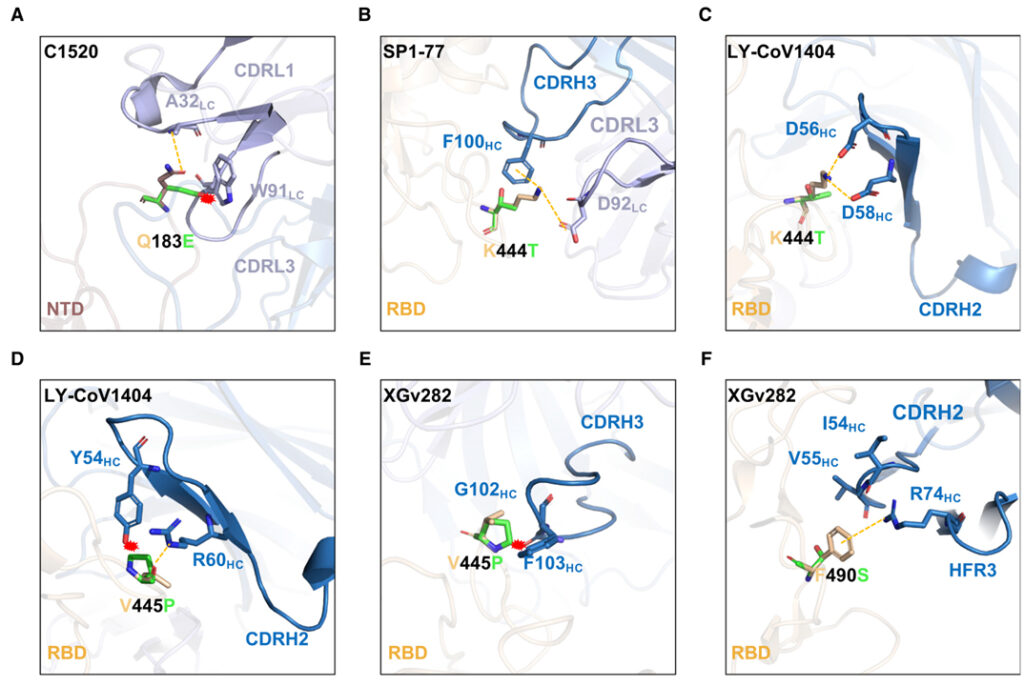
[Figure 4] mAbs 결합에 대한 돌연변이 효과의 구조 분석
(A–F) 각 돌연변이가 RBD class 3 mAb에 미치는 영향에 대한 모델링.
(A) Q183E, (B-C) K444T, (D-E) V445P, (F) F490S
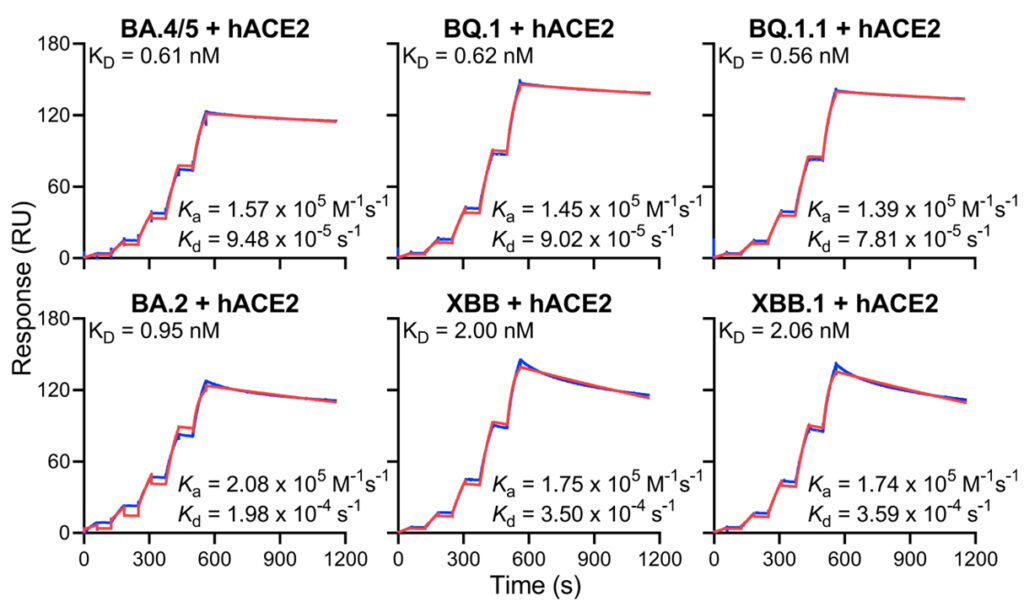
[Figure 5] Omicron subvariant 스파이크의 수용체 결합 친화도
각 스파이크를 prefusion-stabilized trimers로 생산 및 정제 후 인간 ACE2와 결합에 대한 SPR 측정 결과.
Disscussion
요약하면, 우리는 SARS-CoV-2 Omicron BQ.1, BQ.1.1, XBB 및 XBB.1 하위 변이체의 항체 저항성 프로파일과 바이러스 수용체 결합 친화도를 자세히 조사했습니다. 이는 전 세계적으로 빠르게 확장되고 있으며 이미 지역적으로 우세합니다. 우리의 데이터는 이러한 새로운 하위 변이체가 최근에 새로운 2가 (WA1/BA.5) mRNA 백신으로 강화된 사람을 포함하여 사전 감염 유무에 관계없이 백신 접종된 개인의 혈청에 의한 중화에 거의 영향을 받지 않는다는 것을 보여줍니다. 여기에서 측정된 항원 드리프트 또는 이동의 정도는 1년 전 초기 오미크론 변이체가 이전 변종에서 만든 항원 도약과 비슷합니다. 사실, 이러한 결과를 선별된 sarbecovirus의 혈청 중화에 대한 이전 연구 결과와 결합하면 XBB 및 XBB.1이 이제 동물의 SARS-CoV 또는 일부 sarbecovirus보다 항원적으로 더 멀리 떨어져 있다는 징후가 있습니다. 따라서 새로 등장한 하위 변이체가 현재 COVID-19 백신의 효능을 더욱 손상시키고 돌발 감염과 재감염의 급증을 초래할 수 있다는 점에 경악을 금치 못합니다. 그러나 이제 감염 가능성이 더 높아질 수 있지만 COVID-19 백신은 Omicron에 대해서도 입원 및 중증 질환을 예방하고 COVID-19의 급성 후유증 위험을 줄이는 데 여전히 효과적인 것으로 나타났음을 강조하는 것이 중요합니다.
우리는 또한 이러한 새로운 하위 변이체가 긴급 사용 승인을 받은 것을 포함하여 테스트된 대부분의 mAb에 의한 중화에 대해 완전히 또는 부분적으로 저항한다는 것을 보여주었습니다. 이 발견은 혈청 중화 활성의 상실 뒤에 있는 원인을 정의하는 데 도움이 되었습니다. BQ.1와 BQ.1.1은 RBD class 1, class 3 에피톱을 표적으로 하는 항체에 대체로 pan-resistance인 반면, XBB 및 XBB.1은 RBD class 1, 2, 3 에피톱을 표적으로 하는 항체에 대해 pan-resistance입니다. 이러한 BQ 및 XBB 하위 계통은 몇 개의 mAb가 통과하여 Omicron을 무력화할 수 있도록 하는 “구멍을 채우는” 것처럼 보이는 추가 돌연변이를 진화시켰습니다. 흥미롭게도, 두 하위 계통은 항체 회피를 향상시키기 위해 동일 (R346T와 N460K) 또는 유사한 솔루션 (K444T vs V445P와 G446S)에 수렴되었습니다. 또한 이전에 설명되지 않은 세 가지 (Q183E, K444T, V445P)를 포함하여 다양한 점 돌연변이의 항체 저항성에 대한 구조적 설명을 제공했습니다.
아마도 이러한 mAb 연구의 가장 중요한 결과는 COVID-19를 치료하거나 예방하기 위해 mAb를 사용하는 것에 대한 임상적 의미일 것입니다. 이전 SARS-CoV-2 변종은 이미 임상적으로 승인된 치료용 항체 (bamlanivimab, etesevimab, imdevimab, casirivimab, tixagevimab, cilgavimab, sotrovimab)의 사용을 성공적으로 중단했으며, bebtelovimab은 순환 SARS-CoV- 2 균주에만 활성을 가짐을 가집니다. 불행하게도, BQ와 XBB 하위 계통 모두 이제 bebtelovimab에 완전히 내성이 있어 치료용으로 승인된 항체가 없습니다. 또한 COVID-19 예방을 위해 승인된 Evusheld로 알려진 mAbs 조합도 새로운 하위 변형에 대해 완전히 비활성화됩니다. 이는 COVID-19 백신에 강력하게 반응하지 않는 수백만 명의 면역 저하 개인에게 심각한 문제를 제기합니다. 임상용 활성 mAb를 개발해야 하는 시급한 필요성은 명백합니다.
마지막으로, 우리는 BQ 및 XBB 하위 변이체의 스파이크가 이전 하위 변이체의 스파이크와 유사한 hACE2에 대한 결합 친화도를 가지고 있음을 발견했으며, 이는 이러한 새로운 하위 변이체에 대해 최근 관찰된 성장 이점이 일부 다른 요인 때문일 가능성이 있음을 시사합니다. 특히 지난 3년 동안 감염 및 백신 접종으로 인구에 축적된 광범위한 집단 면역을 고려할 때 가장 중요한 것은 극단적인 항체 회피 특성일 수 있습니다. BQ.1, BQ.1.1, XBB 및 XBB.1 하위 변종은 이전 변종보다 훨씬 더 큰 항체 저항성을 나타내며 COVID-19 감염의 또 다른 급증을 촉진할 수 있습니다. 우리는 2년 넘게 SARS-CoV-2 변종을 집단적으로 추적했지만 바이러스는 계속 진화하고 회피하고 있습니다. 이 계속되는 도전은 광범위하게 보호하고 SARS-CoV-2의 항원 궤적을 예상하는 백신 및 mAb 접근법 개발의 중요성을 강조합니다.