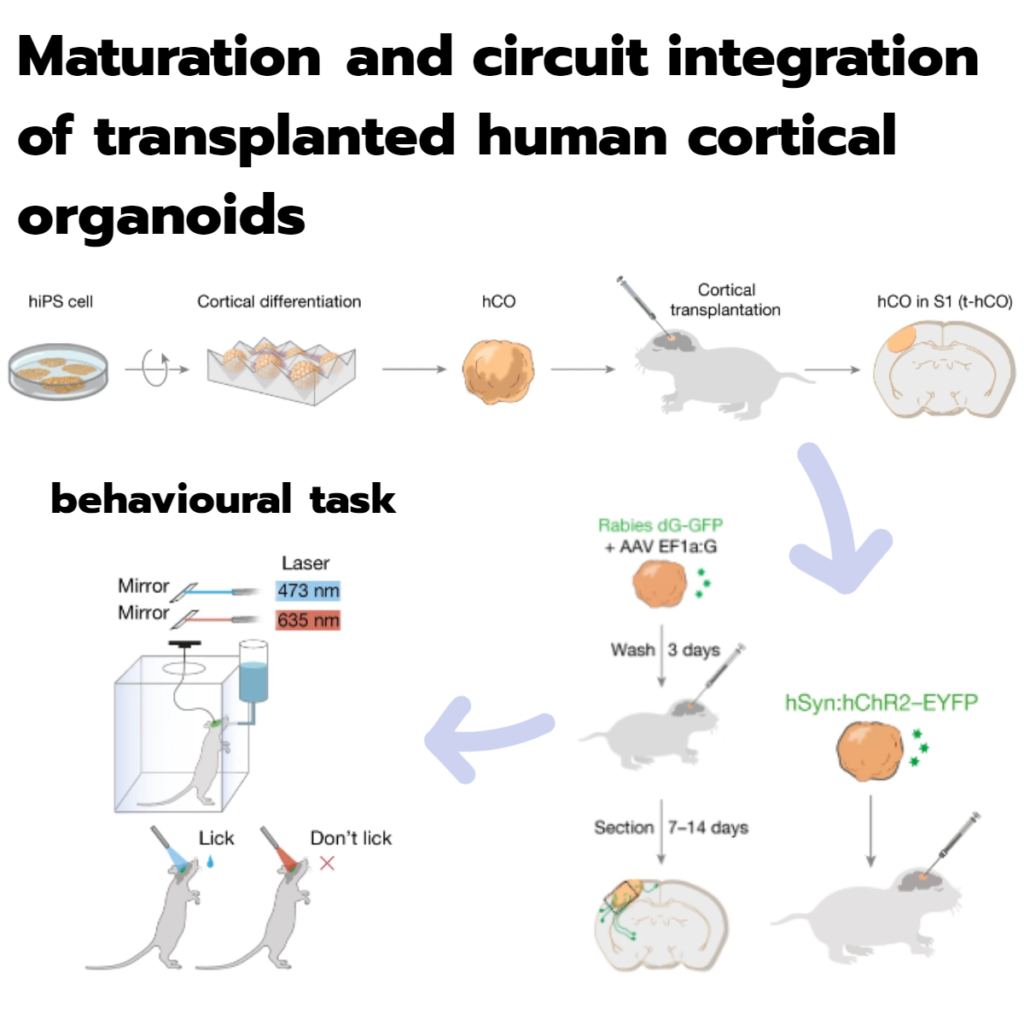
이식된 human cortical organoid의 성숙 및 회로 통합
Abstract
Self-organizing neural organoid는 인간의 발달과 질병을 모델링하는 유망한 in vitro 플랫폼을 나타낸다. 그러나 organoid는 in vivo에 존재하는 연결성이 부족하여 maturation을 제한하고 동작을 제어하는 다른 회로와의 통합을 불가능하게 만든다.
여기서 우리는 newborn athymic rat의 somatosensory cortex에 이식된 human stem cell-derived cortical organoid가 감각 및 동기 관련 회로에 통합된 mature 세포 유형을 발달시킨다는 것을 보여준다. MRI는 multiple stem cell line 및 동물에 걸쳐 이식 후 organoid의 성장을 보여주는 반면, single-nucleus profiling은 corticogenesis의 진행과 activity-dependent transcriptional program의 출현을 보여준다. 실제로 이식된 cortical neuron은 in vitro counterpart보다 더 복잡한 형태학적, 시냅스적, 내재적 막 특성을 나타내므로 티모시 증후군을 가진 개체에서 파생된 뉴런의 결함을 발견할 수 있다. 해부학적 및 기능적 추적은 이식된 organoid가 thalamocortical and corticocortical input을 받는다는 것을 보여주며, 신경 활동의 in vivo 기록은 이러한 입력이 인간 세포에서 감각 반응을 생성할 수 있음을 보여준다.
마지막으로, cortical organoid는 쥐의 뇌 전체에 axon을 확장시키고 optogenetic activation는 보상을 추구하는 행동을 촉진할 수 있다. 따라서, 이식된 인간의 cortical neuron은 성숙하고 행동을 제어하는 숙주 회로와 결합한다. 우리는 이 접근 방식이 달리 발견될 수 없는 환자 유래 세포에서 circuit-level phenotype을 탐지하는 데 유용할 것으로 기대한다.
Figure
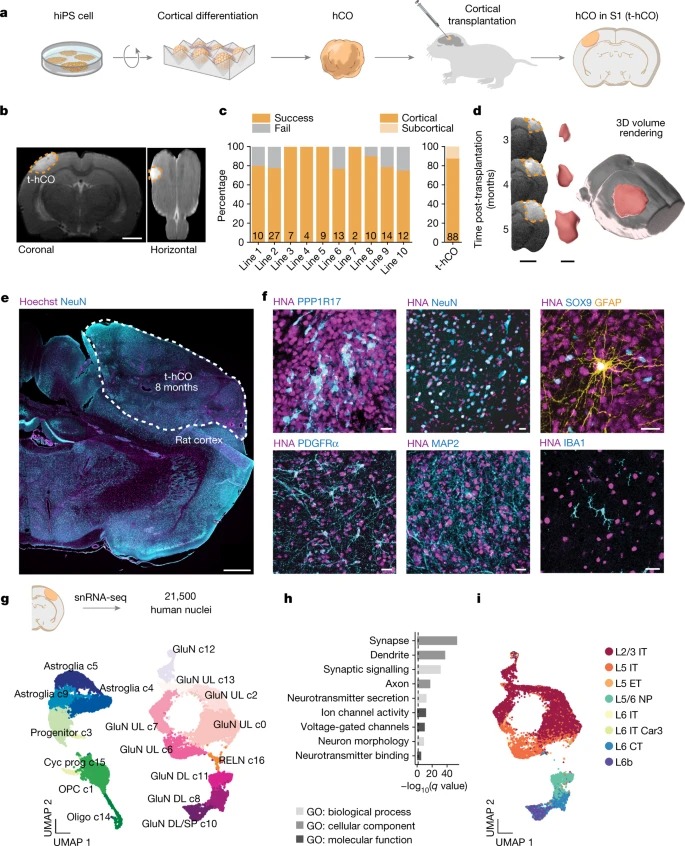
Fig. 1: Developing rat cortex에 human cortical organoid 이식.
a, 실험 설계의 개략도.
b, 이식 후 2개월에 S1에서 t-hCO를 보여주는 coronal and horizontal view T2-weighted MRI 이미지.
c, hiPS cell line당 표시된 이식 성공률 정량화(n = 108, bar 내부 숫자는 hiPS 세포 라인당 t-hCO의 수를 나타냄) 및 cortical or subcortical 위치(n = 88)
d, Coronal MRI 영상 및 3개월 이상 t-hCO 성장을 나타내는 해당 3D 볼륨 재구성.
e, rat cortex의 예시 t-hCO의 개요.
f, t-hCO의 대표적인 면역세포화학 이미지(분화 시점).
g, snRNA-seq: Sureat 통합 후 모든 클러스터된 고품질 t-hCO 핵의 균일한 매니폴드 근사 및 투영(UMAP) 치수 감소 시각화.
h, hCO glutamatergic neuron과 비교하여 t-hCO glutamatergic neuron의 genes significantly upregulated의 Gene Ontology (GO) term enrichment analysis.
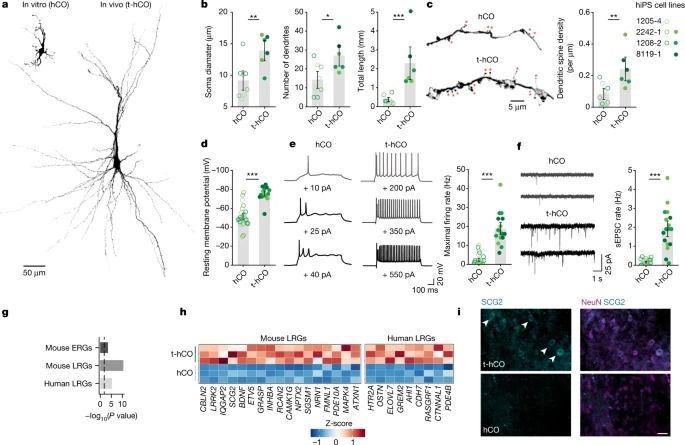
Fig. 2: t-hCO neuron은 advanced maturation을 겪는다.
a, 분화 8개월에서 biocytin-filled hCO 및 t-hCO 뉴런의 3D 재구성.
b, 형태학적 특징의 정량화.
c, 분화 8개월 후 hCO와 t-hCO의 3D 재구성 dendritic branch.
d, action potential 정량화.
e, current injection 증가에 의해 유도된 hCO 및 t-hCO에서의 반복적인 action potential firing 및 최대 firing rate의 정량화
f, 8개월 분화 시 hCO 및 t-hCO 뉴런의 자발적 EPSC(sEPSC)와 시냅스 이벤트 빈도 정량화
g, early-response(ERG) 및 late-response (LRG) activity-dependent gene의 유전자 세트가 확인된 hCO glutamatergic neuron과 비교하여 t-hCO glutamatergic neuron의 유전자에 대한 Gene set enrichment analysis.
h, LRG 유전자 크게t-hCO glutamatergic neuron에 upregulated의snRNA-seq가 가로질러 GluN 유전자 발현
i, t-hCO(상단) 및 hCO(하단) 뉴런에서 SCG2 발현을 나타내는 Immunostaining.
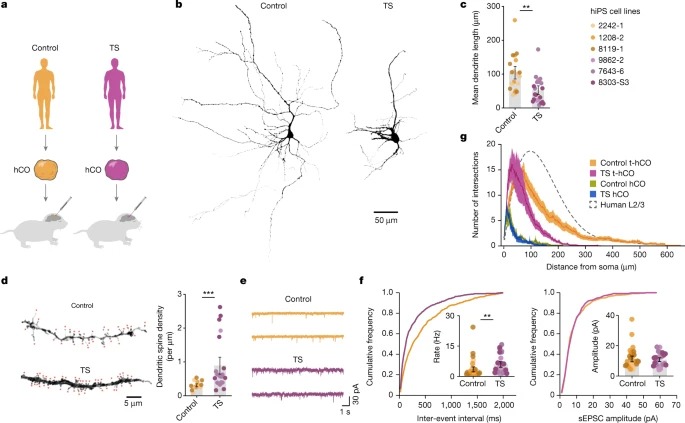
Fig. 3: t-hCO의 advanced neuronal 특징들은human cortical neuron의 activity-dependent disease phenotype을 보여준다.
a, 대조군 및 TshiPS cell line으로부터 생성된 hCO를 newborn rat으로 이식.
b, 분화 8개월에 biocytin-filled t-hCO 뉴런의 3D 재구축.
c, 평균 dendrite 길이 정량화.
d, 8개월 동안 분화 및 dendritic spine density의 정량화를 통해 대조군과 TS t-hCO에서 3D로 재구성된 dendritic branch.
e, 분화 8개월 후 대조군과 TS t-hCO 뉴런 내 자발적 EPSC.
f, 누적 주파수 그림 및 시냅스 이벤트 빈도 및 진폭 정량화.
g, hCO 및 t-hCO에서 TS 및 제어 뉴런의 Sholl analysis.
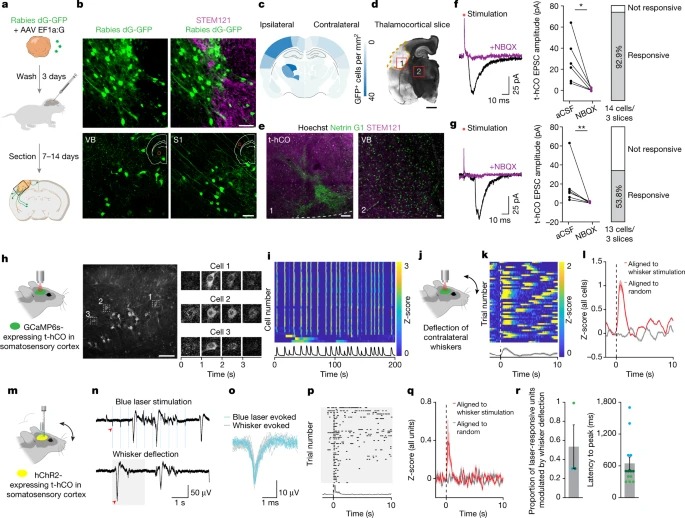
Fig. 4: 이식된 hCO는 sensory-related input을 받는다.
a, 광견병 추적 실험의 개략도.
b, GFP 및 t-hCO와 rat cortex(위) 사이의 human-specific STEM121 expression.
c, GFP 발현 세포의 정량화.
d, e, t-hCO에서 Netring G1+ thalamic terminals.
f,g, rat S1(f) 또는 internal capsule(g)에서 전기적 자극을 받은 후, 흐름 추적(왼쪽) [NBQX가 있을 때 (purple) 없을때 (black)), EPSC 진폭(중간). rat S1(f) 또는 internal capsule (g)의 전기적 자극에 반응하여 EPSC를 표시한 t-hCO 뉴런의 백분율(오른쪽).
h, 2P 영상 실험의 개략도(왼쪽). t-hCO에서 GCaMP6s expression(가운데). GCaMP6s fluorescence 타임랩스(오른쪽).
i, 자발적 활동의 Z-scored fluorescence.
j, whisker stimulation의 개략도.
k, example cell의 시간 0(점선)에서 whisker deflection에 정렬된 Single-trial z-scored 2P fluorescence trace.
l, whisker deflection에 정렬된 모든 셀의 모집단 평균 z-scored 반응.
m, optotagging experiment의 개략도.
n, 파란색 레이저 자극 또는 whisker deflection 중 t-hCO 장치의 Raw voltage trace.
o, 빛과 whisker deflection 반응의 스파이크 파형.
p, example cell의 whisker deflection에 정렬된 Single-trial spiking.
q, 시간 0(점선)(빨간색) 또는 임의로 생성된 타임스탬프(회색)에서 whisker deflection에 정렬된 모든 빛 응답 장치의 모집단 평균 z-scored firing rate.
r, whisker deflection에 의해 크게 변조된 빛 반응 단위 비율(n = 3 래트)(왼쪽). 피크 z-score에 대한 지연 시간(오른쪽).
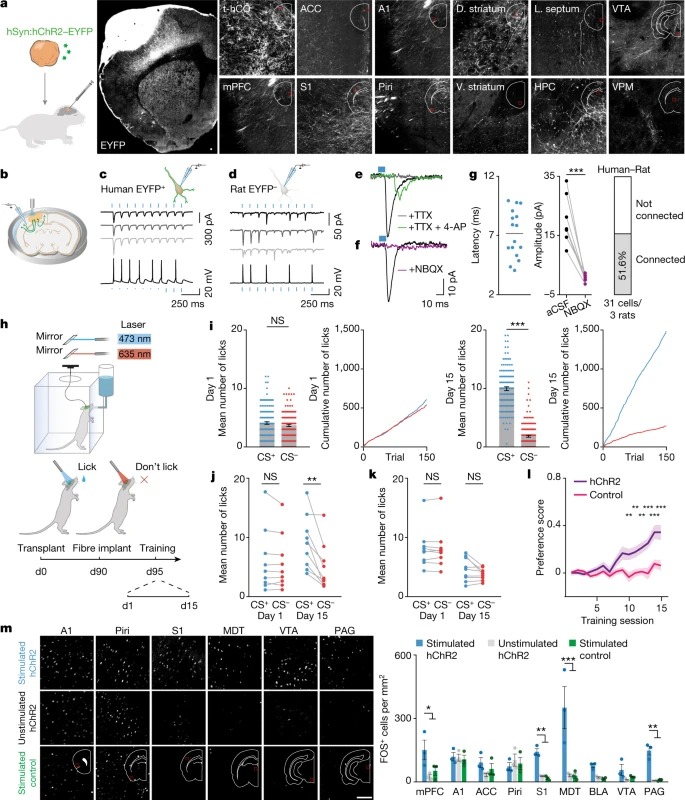
Fig. 5: 이식된 hCO은 rat neuron에 기능적 연결을 만들고 행동을 조절한다.
a, axon tracing의 개략도(왼쪽). t-hCO EYFP expression (오른쪽).
b, 자극 실험의 개략도
c,d, 인간 EYFP+ t-hCO(c) 또는 rat EYFP–세포(d)에서 파란색 빛으로 인한 광전류(위) 및 전압 반응(아래)
e, f, TTX와4-AP(녹색), TTX(회색), CSF(검은색) (e), NBQX포함(보라색) 또는 없음(검은색) (f)의 T-hCO axon의 파란색 빛 자극에 따른 rat 뉴런의 current trace.
g, rat cell의 blue light-evoked Latency (왼쪽). NBQX를 사용하거나 사용하지 않고 기록된 light-evoked EPSC의 진폭(중간). 파란색 빛에 반응하여 EPSC를 보여준 rat cell의 백분율(오른쪽).
h, 행동 과제의 개략도. d0, day 0.
i, 훈련 1일차(왼쪽) 또는 15일차(오른쪽)의 예시 동물 수행.
j,k, 1일째 또는 15일째에 hChR2–EYFP(j) 또는 대조군 fluorophore (k)를 발현하는 t-hCO로 이식된 모든 동물의 행동 성능.
Discussion
Neural organoid는 in vitro에서 인간의 발달과 질병을 탐구할 수 있는 유망한 시스템을 대표하지만, in vivo에 존재하는 회로 연결성의 부족으로 인해 제한된다. 우리는 인간의 세포 발달과 in vivo 기능을 조사하기 위해 early-postnatal immunocompromised rat의 S1에 hCO를 이식하는 새로운 플랫폼을 개발했다. 우리는 t-hCO가 in vitro에서 볼 수 없는 mature cell type을 발달시키고, t-hCO가 해부학적으로나 기능적으로 rodent 뇌에 통합된다는 것을 입증했다. rodent 신경 회로로의 t-hCO의 통합은 인간 세포의 활동과 학습된 동물 행동 사이의 연관성을 확립할 수 있게 해주었으며, 이는 t-hCO 뉴런이 행동 반응을 촉진하기 위해 rat 뉴런의 활동을 조절할 수 있음을 보여준다.
우리가 설명한 플랫폼은 인간 세포를 rodent 뇌에 이식한 이전의 연구들에 비해 몇 가지 장점이 있다. 첫째, 우리는 hCO를 early-postnatal rat의 발달 중인 cerebral cortex에 이식했는데, 이는 아마도 해부학적 및 기능적 통합을 선호할 것이다. 둘째, t-hCO의 MRI 모니터링을 통해 살아있는 동물의 이식 위치 및 성장을 검사할 수 있었고, 여러 동물에 대한 장기 연구를 수행하고 여러 hiPS cell line에 대한 신뢰성을 확립할 수 있었다. 마지막으로, 우리는 해리된 single-cell suspension이 아닌 온전한 organoid를 이식했는데, 이는 인간 세포에 덜 파괴적이고 아마도 쥐의 뇌에서 human cortical neural cell의 단위의 생성과 통합을 용이하게 할 것이다.
우리는 이 플랫폼이 제공하는 발전에도 불구하고 개발 초기 단계에서 이식 후에도 높은 충실도로 인간 신경 회로의 형성을 방해하는 시간적 공간적 및 cross-species limitation이 있다는 것을 인식한다. 예를 들어, 현재 t-hCO에서 관찰된 자발적 활성은 cortical development에서 관찰된 리듬 활성과 유사한 발달 표현형을 나타내는 것인지, 아니면 t-hCO에 존재하는 억제 세포 유형의 부족과 관련이 있는지는 불분명하다. 마찬가지로, t-hCO의 라미네이션 부족이 회로 연결성에 어느 정도 영향을 미칠 수 있을지는 불확실하다. 향후 연구는 assembloid를 사용하여 in vitro에서 보여진 바와 같이 인간 microglia, 인간 endothelial cell 및 다양한 비율의 GABAergic intereuron과 같은 다른 세포 유형을 통합하는 것과 transcriptional, synaptic and behavioural level에서 환자 유래 t-hCO에서 신경 통합과 처리가 어떻게 변경될 수 있는지 이해하는 것을 목표로 할 것이다.
전반적으로, 이 in vivo 플랫폼은 인간의 뇌 발달과 질병에 대한 in vitro를 보완하는 강력한 자원을 나타낸다. 우리는 이 플랫폼을 통해 달리 이해하기 어려웠던 환자 유래 세포에서 circuit-level phenotype을 발견하고 새로운 치료 전략을 테스트할 수 있을 것으로 기대한다.